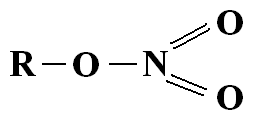BarbaRatje schreef:Hallo allemaal,
ik heb een vraag naar aanleiding van een tekening die mijn scheikundedocent op het bord maakte:
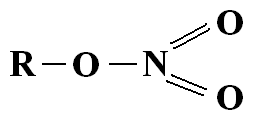
Hierin is R een restgroep.
Hierop reageerde de hele klas met "maar stikstof is toch driewaardig", waarop de leraar antwoordde dat het atoom ook vijfwaardig kon zijn. Inmiddels heb ik begrepen dat, omdat het atoom 5 elektronen in de buitenste schil heeft, je het atoom kan zien als 3- of 5+. Daarom zou, zoals in het voorbeeld met zuurstofatomen, het atoom 5 elektronen kunnen afstaan (aangezien zuurstof = O 2-, en één van de atomen 'leent' al één elektron van de restgroep), terwijl het atoom driewaardig is bij hechting aan waterstofatomen (die H+ zijn).
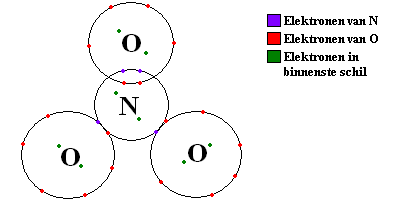
Je leraar haalt valentie en oxidatietoestand door elkaar, of hij gaat voor dit moment voorbij aan het verschil. De tekening die hij op het bord zette is in ieder geval fout. Stikstof kan géén 5 bindingen aangaan. Geen enkel element uit die periode kan dat, het houdt op bij 4 bindingen. Je kunt nitraten wél als volgt voorstellen: (het plaatje laat een nitraat-ion zien)
Plaatje van Wikipedia
Hierbij heeft N dus 4 bindingen, waarbij de 4e binding is verdeeld over de 3 O-atomen. Omdat N 4 bindingen heeft, en geen vrij elektronenpaar, heeft N dus 4 atomen in de buitenste schil. Samen met 2 elektronen van de eerste schil maakt dit 6. Er zitten 7 protonen in de kern, dus dit N-atoom heeft een lading van +1. Dit noemt men de formele lading. Maak je dezelfde berekening voor de O-atomen dan zie je dat een O-atoom waar een dubbele binding aanzit een lading heeft van 0, terwijl de andere O-atomen een lading van -1 dragen. In totaal heeft het molecuul dus een lading van -1.
De oxidatietoestand van N kan wél +5 zijn. Maar de oxidatietoestand is geen echte lading. Het is een getalletje dat je toekent om te kunnen boekhouden met elektronen. Er zijn regels voor om dit te kunnen berekenen, en en van de regels is dat een O-atoom "standaard" een lading van -2 krijgt toegekend. In het geval van het nitraation zit er dus totaal een lading van -6 aan het N-atoom vast. Het gehele deeltje heeft een lading van -1, met andere woorden, de oxidatietoestand van N moet dan +5 zijn. Dit houdt inderdaad wel losjes verband met het feit dat een N-atoom 5 elektronen in de buitenste schil heeft zitten.
Als hetzelfde aan de hand is bij koolstofatomen, waarbij je bij hechting aan zuurstofatomen CO2 krijgt, en methaan bij hechting aan waterstof atomen, dan kun je het C-atoom in CO2 beshouwen als '4+', en het C-atoom in methaan als '4-'. Toen ben ik gaan kijken naar de consequenties voor bijv. methanol.
Dat geldt inderdaad voor de oxidatietoestand.
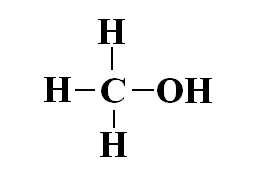
Het koolstofatoom 'leent' dan 3 elektronen van de waterstofatomen, maar 'leent er een uit' aan het zuurstofatoom. Ik kan me niet voorstellen dat je het C-atoom als 2- oid zou beschouwen.
Toch is het wel zo. Een oxidatietoestand van -2 voor een C-atoom is helemaal niet vreemd.
Als ik methanol ga uittekenen op elektronenniveau, dan begrijp ik wel waarom het toch kan werken (aangezien de elektronen niet echt 'uitgeleend' worden, maar eerder gedeeld door de atomen).
Dat is het principe. De elektronen worden gedeeld, maar voor het bepalen van de oxidatietoestand doe je net of ze volledig worden overgedragen van één atoom naar een ander. Jij noemt dat uitlenen, dat vind ik eigenlijk wel een mooie term.
Als ik echter ga proberen om hetzelfde te doen (het uittekenen) met vijfwaardig stikstof, dan kom ik in de problemen. Ik denk dat ik iets essentieels mis in het hele principe. Ik hoop dus dat iemand me kan uitleggen wat ik verkeerd doe.
Probeer het nu nog eens voor het nitraation zoals in het plaatje waar ik naar verwees.