[scheikunde] dipoolmoment
Moderators: ArcherBarry, Fuzzwood
- Berichten: 22
[scheikunde] dipoolmoment
Hallo,
ik snap niet hoe ik erachter kan komen wat de ruimtelijke bouw van een molecuul is. In de BINAS staan de bindingshoeken van enkele moleculen maar ik weet niet hoe ik daarmee kan zien wat voor bouw het molecuul heeft.
En ik kan dus ook niet begrijpen hoe ik een vraag als deze moet oplossen: 'Moleculen van methaan en tetrafluormethaan zijn geen dipolen. Moleculen van difluormethaan zijn wel dipolen. Leg dit uit aan de hand van de elektronegativiteit van de atomen en de ruimtelijke structuur van de moleculen.'
Elektronegativiteit opzoeken: C=2,5 H=2,1 - F=4,1.
Moet ik nu bij methaan 1x2,5 tegenover 4x2,1 bekijken? En dus bij tetrafluormethaan 4x4,1 tegenover 1x2,5?
En dan de ruimtelijke bouw bekijken, en dat snap ik niet.
Ik heb al een tijd zitten zoeken op internet naar een duidelijke uitleg over dipoolmomenten maar ik kan niks vinden, niet iets waardoor ik het beter kan snappen. En in mijn boek besteden ze er erg kort aandacht aan, maar het komt wel uitgebreid in de toets voor.
Alvast bedankt!
ik snap niet hoe ik erachter kan komen wat de ruimtelijke bouw van een molecuul is. In de BINAS staan de bindingshoeken van enkele moleculen maar ik weet niet hoe ik daarmee kan zien wat voor bouw het molecuul heeft.
En ik kan dus ook niet begrijpen hoe ik een vraag als deze moet oplossen: 'Moleculen van methaan en tetrafluormethaan zijn geen dipolen. Moleculen van difluormethaan zijn wel dipolen. Leg dit uit aan de hand van de elektronegativiteit van de atomen en de ruimtelijke structuur van de moleculen.'
Elektronegativiteit opzoeken: C=2,5 H=2,1 - F=4,1.
Moet ik nu bij methaan 1x2,5 tegenover 4x2,1 bekijken? En dus bij tetrafluormethaan 4x4,1 tegenover 1x2,5?
En dan de ruimtelijke bouw bekijken, en dat snap ik niet.
Ik heb al een tijd zitten zoeken op internet naar een duidelijke uitleg over dipoolmomenten maar ik kan niks vinden, niet iets waardoor ik het beter kan snappen. En in mijn boek besteden ze er erg kort aandacht aan, maar het komt wel uitgebreid in de toets voor.
Alvast bedankt!
- Berichten: 711
Re: [scheikunde] dipoolmoment
Voor de dipool kijk je per binding. In het geval van CH4 zoek je het elektronegativiteitsverschil uit voor de binding C-H. En voor CF4 bekijk je de C-F binding.
Op wikipedia staat een tabelletje wanneer je spreekt over een dipoolmoment:
[attachment=4438:8d1686fa...d8c471c6.png]
Bij een
Bij CH4 is er geen ladingsverschuiving (
Nu moet je de ruimtelijke structuur beschouwen, om te bepalen of er een netto dipoolmoment is.
CF4 is tetraëdisch.
In het plaatje staan de rode pijlen voor de dipoolmomenten. Die wijzen altijd van de positieve lading naar de negatieve lading.
De dipoolvectoren doven elkaar uit. Er is dus geen netto dipool.
Misschien niet zo handig te zien in het bovenstaande plaatje, maar in het 3D model wel:
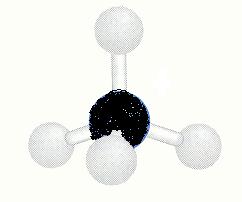
Hierin moet je de H-atomen (wit) even als F-atomen denken.
Op wikipedia staat een tabelletje wanneer je spreekt over een dipoolmoment:
[attachment=4438:8d1686fa...d8c471c6.png]
Bij een
\(\Delta\)
EN waarde tussen de 0,5 en de 1,6 is er sprake van een ladingsverschuiving binnen de binding. Dat wil zeggen dat bijvoorbeeld in de C - F binding (\(\Delta\)
EN = 4.1 - 2.5 = 1.6) er een kleine negatieve lading (\(\delta\)
-) op het F-atoom zit en een kleine positieve lading (\(\delta\)
+) op het C-atoom.Bij CH4 is er geen ladingsverschuiving (
\(\Delta\)
EN < 0,5). Nu moet je de ruimtelijke structuur beschouwen, om te bepalen of er een netto dipoolmoment is.
CF4 is tetraëdisch.
In het plaatje staan de rode pijlen voor de dipoolmomenten. Die wijzen altijd van de positieve lading naar de negatieve lading.
De dipoolvectoren doven elkaar uit. Er is dus geen netto dipool.
Misschien niet zo handig te zien in het bovenstaande plaatje, maar in het 3D model wel:
Hierin moet je de H-atomen (wit) even als F-atomen denken.
- Bijlagen
-
- 8d1686fad938cb1c3ce2fb64d8c471c6.png (3.39 KiB) 818 keer bekeken
- Berichten: 22
Re: [scheikunde] dipoolmoment
Bedankt voor je duidelijke uitleg!
Rest bij mij alleen nog de vraag: hoe weet ik dat CF4 tetraëdrisch is? De bindingshoek van FCF staat niet in de BINAS.
Rest bij mij alleen nog de vraag: hoe weet ik dat CF4 tetraëdrisch is? De bindingshoek van FCF staat niet in de BINAS.
- Berichten: 711
Re: [scheikunde] dipoolmoment
Staat er in je boek ook niets over de VSEPR-methode?
VSEPR:
Bepaal de som van het aantal bindingpartners en het aantal vrije elektronenparen.
(in ons voorbeeld zijn er geen vrije elektronenparen, maar wel 4 bindingspartners)
4 bindingen = tetraëdisch
3 bindingen = driehoekig vlak
2 bindingen = lineair
Dus het CF4-molecuul is tetraëdisch.
Zie voor meer info: VSEPR op Wikipedia.
VSEPR:
Bepaal de som van het aantal bindingpartners en het aantal vrije elektronenparen.
(in ons voorbeeld zijn er geen vrije elektronenparen, maar wel 4 bindingspartners)
4 bindingen = tetraëdisch
3 bindingen = driehoekig vlak
2 bindingen = lineair
Dus het CF4-molecuul is tetraëdisch.
Zie voor meer info: VSEPR op Wikipedia.
- Berichten: 22
Re: [scheikunde] dipoolmoment
Sorry dat ik niet eerder meer gereageerd heb.
Ik heb nog nooit gehoord van de VSEPR-methode. Bedankt voor de informatie en de link!
Ik heb nog nooit gehoord van de VSEPR-methode. Bedankt voor de informatie en de link!