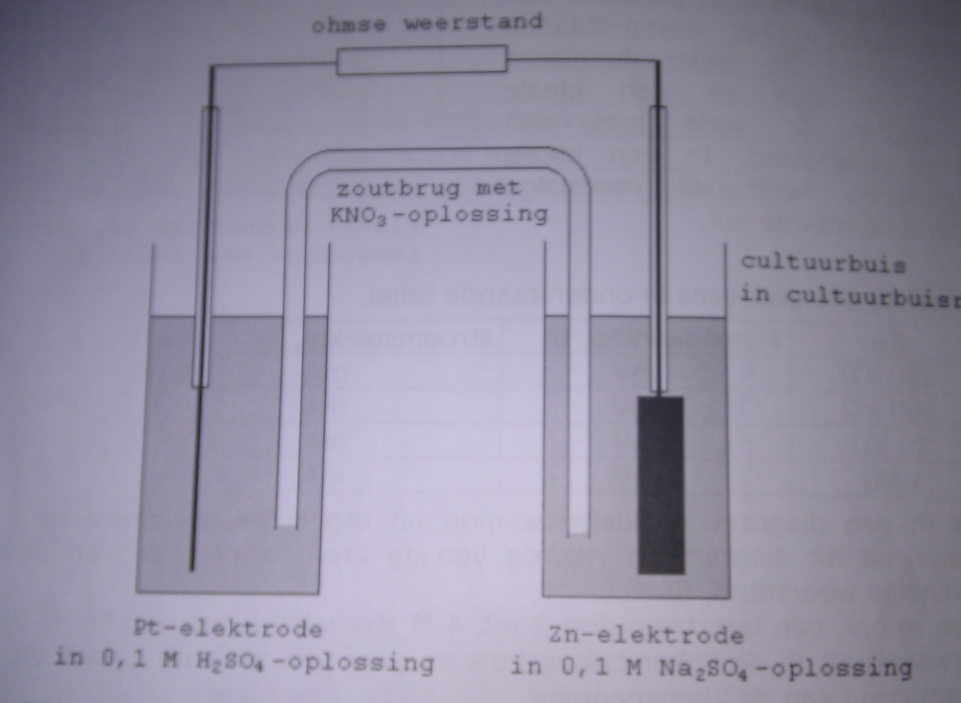
Voor scheikunde (vwo6) hebben we een practicum gekregen over de elektrochemische cel. (zie onderstaande afbeelding).
Helaas kom ik hier niet echt doorheen, voor vanwege het volgende over de plus en minpolen.
Dit heb ik gevonden op dit forum:
Bij de + pool treedt een reactie op die elektronen nodig heeft.
Bij de - pool treedt een reactie op die elektronen oplevert.
Nu is het zo dat ik op de volgende halfreacties ben gekomen:
De halfreactie van de eerste buis: H2 -> 2H+ + 2e-
De halfreactie van de tweede buis: SO42- + H2O +2e- -> SO32- + 2OH-
Dus ik dacht dat in buis 1 (met Pt) de - pool bevatte, en buis 2 de + pool.
Helaas is de vraag zo dat je moet verklaren waarom de Pt-elektrode de + pool van deze cel is en de Zn-elektrode de - pool.
Hier kom ik dus niet verder, begrijp ik de uitleg van de plus en minpool verkeerd, heb ik de verkeerde halfreacties of ben ik nu dingen door elkaar aan het halen?
Alvast bedankt.
Mvg KBcat