Een vraag over een onderwerp dat de laatste paar dagen vaker op dit forum voor is gekomen
Zoals meerdere scholieren ben ik bezig met een scheikunde proef waarbij ik de hoeveelheid acetylsalicylzuur probeer te achterhalen.
Ik heb het volgende stappenplan gevolgd
1. weeg een aspirinetablet af (0.59 gram)
2. voeg 10ml H20 & 10ml 1M NaOH toe
3. kook het mengsel gedurende 10 min om het te hydrolyseren
4. breng het over in een maatkolf van 100ml en voeg H2O toe tot de maatstreep
5. pipetteer 10ml vd oplossing in een erlenmeyer
6. titreer dit met 0.1M HCL, gebruik FFT als indicator
Dit is allemaal gelukt en dit zijn de uitkomsten van de berekening zoals ik ze tot nu toe heb
Code: Selecteer alles
De gemiddelde benodigde hoeveelheid HCL bij de titratie was 4.10ml. De molmassa van HCL is 36.46gram. Gereageerd heeft 4.10ml * 0.1M = 0.41mmol
Zoals eerder vermeld is de molverhouding in de reactie 1:1, waaruit volgt dat er ook 0.41mmol OHï heeft gereageerd. Omdat we bij Stap 4 de oplossing hebben verdunt met factor 10, moeten we deze waarde met 10 vermenigvuldigen. Er was dus 4.10mmol HCL nodig.
De beginhoeveelheid natronloog was 10ml * 1M = 10mmol
10mmol - 4.10mmol = 5.90mmol NaOH
1 mol aspirine reageert met 2 mol OHï, er was dus 5.90 / 2 = 2.95mmol aspirine aanwezig.
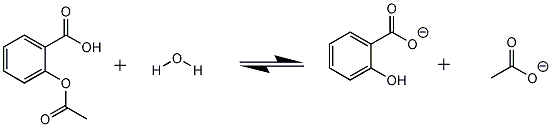
De molmassa van aspirine bedraagt 180.16gram 0.00295 * 180.16 = 0.531gram ~ 531mgOpzich is het allemaal wel duidelijk, alleen vraag ik me een ding af.. Met het programma chemoffice heb ik een reactievergelijk gemaakt van het mengsel dat ik heb gehydrolyseerd, de afbeelding ziet er als volgt uit:
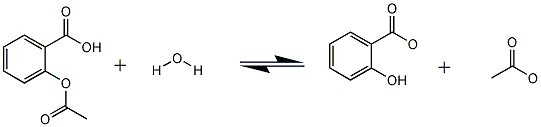
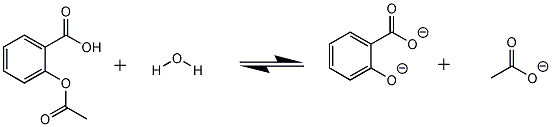
De reactie gaat onder de werking van natronloog, vandaar ik COO-groepen heb getekend ipv COOH.
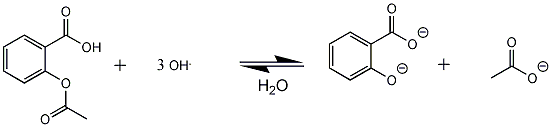
Nu is mijn vraag, reageert de H van de OH-groep van salicylzuur ook met loog?
In dit geval zou ik mijn reactieverlijking nl. aan moeten passen, nu reageert 1 mol aspirine met 2 mol natronloog, in het geval dat die H ook meedoet aan de reactie, zal ik 3 ipv 2 mol natronloog nodig hebben bij de reactie..
Ik hoop dat iemand mij kan helpen en weet waar ik de informatie kan vinden. Het schijnt namelijk ze te zijn dat de H van de OH groep een zuurkarakter heeft.
Mvg. Elger