Hoe komt het dat de pKa waardes van maleïnezuur en fumaarzuur verschillen en waarom heeft maleïnezuur meerdere pKa waardes?
Ook het verschil van oplosbaarheid in water van beide stoffen is mij niet echt duidelijk
Alvast bedankt
Moderators: ArcherBarry, Fuzzwood

Verklaar je daar een factor 60 in oplosbaarheid mee?DrQuico schreef:
Wat betreft het oplosbaarheidsverschil: wat is de invloed van deprotonering van organische zuren op de oplosbaarheid hiervan? Kun je dit koppelen aan de lagere pKa1 waarde van maleinezuur?
Hmm, de Ka-waardes schelen een factor van 15 voor beide zuren. Dus misschien is dit toch niet het hele verhaal.Verklaar je daar een factor 60 in oplosbaarheid mee?
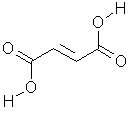
Dat lijkt me incorrect.... waarom zou maleinezuur geen intermoleculaire waterstof-bruggen kunnen vormen?? Deze zijn nu juist meestal de reden dat stoffen goed oplosbaar zijn in water!Maleïnezuur kan interne H-bruggen vormen maar geen intermoleculaire.
Omdat het veel gemakkelijker intramoleculaire H-bruggen vormt, gaat het geen intermoleculaire H-bruggen vormen.Dat lijkt me incorrect.... waarom zou maleinezuur geen intermoleculaire waterstof-bruggen kunnen vormen?? Deze zijn nu juist meestal de reden dat stoffen goed oplosbaar zijn in water!WinterGotha schreef:Maleïnezuur kan interne H-bruggen vormen maar geen intermoleculaire.