[scheikunde] lewisformule en sterisch getal van NH4SCN
Moderators: ArcherBarry, Fuzzwood
-
- Berichten: 2
[scheikunde] lewisformule en sterisch getal van NH4SCN
Zou iemand me kunnen helpen bij het zoeken van de lewisformulevan NH4SCN.
Weet iemand hier ook het sterisch getal van?
Weet iemand hier ook het sterisch getal van?
-
- Berichten: 183
Re: [scheikunde] lewisformule en sterisch getal van NH4SCN
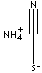
Zo ziet de lewisstructuur er dus uit. De meest bekende naam hiervoor is Ammonium thiocyanate (een ammoniumzout dus ...)
-
- Berichten: 857
Re: [scheikunde] lewisformule en sterisch getal van NH4SCN
van welk atoom wil je het sterisch getal weten?
Om het sterisch getal te bepalen tel je het aantal vrije elektonenparen (van het atoom) op bij het aantal bindingsparters van het atoom.
Hieruit kan je dan weer de hybridisatie van het atoom bepalen.
Voor je C atoom bijvoorbeeld is dit:
0 vrije elektronen paren
2 bindingspartners
het sterisch getal is dus 2. Dit komt overeen met een SP hybride voor je C-atoom.
Om het sterisch getal te bepalen tel je het aantal vrije elektonenparen (van het atoom) op bij het aantal bindingsparters van het atoom.
Hieruit kan je dan weer de hybridisatie van het atoom bepalen.
Voor je C atoom bijvoorbeeld is dit:
0 vrije elektronen paren
2 bindingspartners
het sterisch getal is dus 2. Dit komt overeen met een SP hybride voor je C-atoom.
-
- Berichten: 2
Re: [scheikunde] lewisformule en sterisch getal van NH4SCN
Ik ben aan het werk voor mijn examen en ben een voorbeeldexamen aan het oplossen.
Dit was de vraag die gegeven was.
Geef voor de volgende stoffen CA(HSO4)2 en NH4SCN en CH3CCH
het oxidatiegetal van de centrale atomen
het sterisch getal van de centrale atomen
de geometrie van het molecuul in zijn geheel
de orbitaaltheorie van de verschillende bindingen
de lewisstructuur
Dit was de vraag die gegeven was.
Geef voor de volgende stoffen CA(HSO4)2 en NH4SCN en CH3CCH
het oxidatiegetal van de centrale atomen
het sterisch getal van de centrale atomen
de geometrie van het molecuul in zijn geheel
de orbitaaltheorie van de verschillende bindingen
de lewisstructuur
-
- Berichten: 2.035
Re: [scheikunde] lewisformule en sterisch getal van NH4SCN
Nee, dit is geen Lewis-structuur... dit is een "gewone" structuurformule!Belgjm schreef:
Zo ziet de lewisstructuur er dus uit. De meest bekende naam hiervoor is Ammonium thiocyanate (een ammoniumzout dus ...)
In een Lewis-structuur geeft men voor de buitenste atomen de electronen-omringing aan.

Het electronenpaar tussen N en S is afkomstig van S, maar wordt in de ion-binding "gedeeld" door N en S!
-
- Berichten: 13
Re: [scheikunde] lewisformule en sterisch getal van NH4SCN
heeft N dan niet te veel elektronen? Ik tel nu 10 elektronen, terwijl het maar plaats heeft voor 8 dacht ik..The Herminator schreef: Nee, dit is geen Lewis-structuur... dit is een "gewone" structuurformule!
In een Lewis-structuur geeft men voor de buitenste atomen de electronen-omringing aan.
Het electronenpaar tussen N en S is afkomstig van S, maar wordt in de ion-binding "gedeeld" door N en S!
Groeten,
Mart&Sit
-
- Berichten: 2.035
Re: [scheikunde] lewisformule en sterisch getal van NH4SCN
Ik zie al dat ik hier niet weg ga komen met een "vereenvoudigde" uitleg... het electronenpaar wordt in werkelijkheid niet gedeeld door S en N, maar door de twee complexe ionen als geheel!
Het ammonium is een zogenaamd "Lewis zuur", dat is een verbinding met een lege orbitaal (LUMO) waar een "Lewis base" (zoals het thiocyanaat-ion) 2 electronen (vanuit de HOMO) in kan doneren.... de interactie tussen de twee is dus niet van het "klassieke" type binding, maar electrostatisch!
Er wordt dan ook eigenlijk geen binding gevormd met de N, maar met een lege orbitaal van het gehele (NH4+) complex...
Je ziet bindingen van dit type dan ook wel eens getekend als:

Ook hier zie je dat de traditionele omringing "overtreden" wordt, maar dat komt ook hier doordat je zulke structuren nu eenmaal niet (met behoud van de "juiste" omringing) kan tekenen aan de hand van het klassieke model!
Het ammonium is een zogenaamd "Lewis zuur", dat is een verbinding met een lege orbitaal (LUMO) waar een "Lewis base" (zoals het thiocyanaat-ion) 2 electronen (vanuit de HOMO) in kan doneren.... de interactie tussen de twee is dus niet van het "klassieke" type binding, maar electrostatisch!
Er wordt dan ook eigenlijk geen binding gevormd met de N, maar met een lege orbitaal van het gehele (NH4+) complex...
Je ziet bindingen van dit type dan ook wel eens getekend als:

Ook hier zie je dat de traditionele omringing "overtreden" wordt, maar dat komt ook hier doordat je zulke structuren nu eenmaal niet (met behoud van de "juiste" omringing) kan tekenen aan de hand van het klassieke model!