chloroform
Moderator: ArcherBarry
- Berichten: 11.177
Re: chloroform
Caffeine is een vaste stof, het lijkt me sterk dat chloroform erin oplost.
Je vraag moet eigenlijk zijn, waarom gebruikt men chloroform en niet water om caffeine te extraheren?
Je vraag moet eigenlijk zijn, waarom gebruikt men chloroform en niet water om caffeine te extraheren?
-
- Berichten: 211
Re: chloroform
maar is caffeïne een apolaire stof? Want ik heb ergens gelezen dat chloroform een polair stof is?
- Berichten: 11.177
Re: chloroform
Apolair en polair zijn relatieve termen. Ethanol is apolairder dan water maar polairder dan hexaan. Misschien als je de structuurformule van caffeine eens opzoekt?
- Berichten: 11.177
Re: chloroform
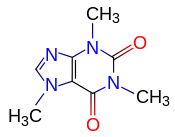
En dat stikt van de zuur- en stikstof niet? Zou je dat apolair willen noemen, of zo polair als water?
Ik denk allebei niet hè? Zou het meer in de range van chloroform (CHCl3) zitten denk je?
-
- Berichten: 211
Re: chloroform
Die vraag bedoel ik,maar ik wist niet hoe je het moest formuleren.FsWd schreef: Caffeine is een vaste stof, het lijkt me sterk dat chloroform erin oplost.
Je vraag moet eigenlijk zijn, waarom gebruikt men chloroform en niet water om caffeine te extraheren?
Waarom gebruikt men chloroform en niet water om caffeine te extraheren?
Antw: Dus ik dacht dat chloroform een tetraëder is. Die dipoolmomenten vallen samen en is dus een apolaire stof. Klopt dat???
- Berichten: 11.177
Re: chloroform
Chloroform is een tetraeder, maar chloroform is trichloormethaan, niet tetrachloormethaan.
- Berichten: 11.177
Re: chloroform
Kijk eens goed naar de structuur van chloroform, ik denk juist dat die een ontzettende dipool heeft met de waterstof bovenop. Maar die is weer niet groot genoeg om op te kunnen lossen water.
-
- Berichten: 211
Re: chloroform
waarom gebruikt men chloroform en niet water om caffeine te extraheren?
Dus het antwoord is: chloroform en water zijn polaire stoffen. Maar omdat cafeïne beter oplost in chloroform wegens een kleiner dipoolmoment.
H - C-Cl3 (chloroform)
H-O-H (water)
Dus het antwoord is: chloroform en water zijn polaire stoffen. Maar omdat cafeïne beter oplost in chloroform wegens een kleiner dipoolmoment.
H - C-Cl3 (chloroform)
H-O-H (water)
- Berichten: 11.177
Re: chloroform
Precies, en omdat je zo alle stoffen kwijtraakt die beter oplossen in water dan in chloroform. Extraheren heet dat.