Polyaniline synthese met persulfaat als oxidator
Moderator: ArcherBarry
-
- Berichten: 5
Polyaniline synthese met persulfaat als oxidator
Ik heb een vraag over het reactiemechanisme van persulfaat.
Ik en een medestudent zijn een project aan het doen over de synthese van polyaniline.
Nu zoeken wij nog het oxidatiemechanisme van de persulfaat.
Dit is alles wat wij hierover kunnen vinden:
S2O82- + 2H+ + 2e- --> 2 HSO4-
Kan iemand mij meer inzicht geven in dit mechanisme. We hebben alles afgezocht, maar verder dan dit komen we niet.
Het gaat vooral over de manier dat H+-ionen wordt afgesplitst van de aniline.
De reactie wordt uitgevoerd in zuur milieu, dus dat dit met een base gebeurd lijkt me zeer sterk.
Alvast bedankt
Ik en een medestudent zijn een project aan het doen over de synthese van polyaniline.
Nu zoeken wij nog het oxidatiemechanisme van de persulfaat.
Dit is alles wat wij hierover kunnen vinden:
S2O82- + 2H+ + 2e- --> 2 HSO4-
Kan iemand mij meer inzicht geven in dit mechanisme. We hebben alles afgezocht, maar verder dan dit komen we niet.
Het gaat vooral over de manier dat H+-ionen wordt afgesplitst van de aniline.
De reactie wordt uitgevoerd in zuur milieu, dus dat dit met een base gebeurd lijkt me zeer sterk.
Alvast bedankt
- Berichten: 336
Re: Polyaniline synthese met persulfaat als oxidator
Twee hints:
Polymerisatie van aniline verloopt typisch via het intermediair p-aminodifenylamine (ADPA). Zoek hier maar eens op. Dit intermediair wordt gevormd na een elektron transferstap en vervolgens dimerisatie. Hier komt je peroxodisulfaat om de hoek kijken: dit is namelijk een beroemde radicaalinitiator. Zoek eens op de Elbs-oxidatie met deze stof.
Polymerisatie van aniline verloopt typisch via het intermediair p-aminodifenylamine (ADPA). Zoek hier maar eens op. Dit intermediair wordt gevormd na een elektron transferstap en vervolgens dimerisatie. Hier komt je peroxodisulfaat om de hoek kijken: dit is namelijk een beroemde radicaalinitiator. Zoek eens op de Elbs-oxidatie met deze stof.
-
- Berichten: 5
Re: Polyaniline synthese met persulfaat als oxidator
Bedankt voor je suggestie.
De polymerisatie hebben we al uitgezocht (zie hieronder)
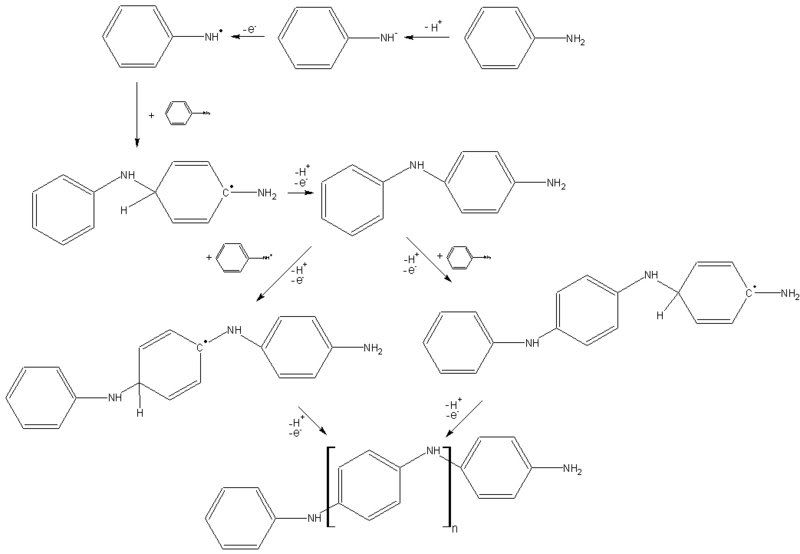
Het gaat vooral om de initiatiereactie.
Wij lossen aniline hydrochloride op in water, waardoor wij een zure oplossing krijgen. De Elbs reactie die je suggereerd lijkt me niet waarschijnlijk, aangezien deze loopt in basisch milieu (of ik begrijp het verkeerd).
Zou iemand nog meer informatie kunnen verstrekken over het mechanisme van de initiatiereactie met ammoniumpersulfaat?? Het gaat dus vooral om de manier waarop de H+ wordt afgesplits (rechtsboven in het schema).
En nog een vraag. Waarom is de polymerisatie para-gericht?? Ik heb begrepen dat dit komt doordat de amine-groep para-richter is, maar hoe werkt dit dan??
De polymerisatie hebben we al uitgezocht (zie hieronder)

Het gaat vooral om de initiatiereactie.
Wij lossen aniline hydrochloride op in water, waardoor wij een zure oplossing krijgen. De Elbs reactie die je suggereerd lijkt me niet waarschijnlijk, aangezien deze loopt in basisch milieu (of ik begrijp het verkeerd).
Zou iemand nog meer informatie kunnen verstrekken over het mechanisme van de initiatiereactie met ammoniumpersulfaat?? Het gaat dus vooral om de manier waarop de H+ wordt afgesplits (rechtsboven in het schema).
En nog een vraag. Waarom is de polymerisatie para-gericht?? Ik heb begrepen dat dit komt doordat de amine-groep para-richter is, maar hoe werkt dit dan??
- Berichten: 336
Re: Polyaniline synthese met persulfaat als oxidator
De Elbs oxidatie vindt zelf niet als zodanig plaats, maar was bedoeld ter vergelijking om je te laten zien hoe deze polymerisatie op de para-positie verloopt én hoe de polymerisatie kan beginnen.
Het stikstofatoom van de aminegroep kan zijn elektronenpaar de ring insturen; dit geeft een resonantiestructuur met een positieve lading op de stikstof en een negatieve lading op de parapositie.
Ik vermoed dat de aminogroep eerst aanvalt op de -O-O- binding van peroxodisulfaat. Dat kan, omdat deze binding zeer labiel is. Vervolgens vindt homolytische splitsing van de N+-O binding plaats. Waarschijnlijk is de SO4. groep ook verantwoordelijk voor deprotonering van de aminefunctie.
Deprotonering als eerste stap lijkt me onwaarschijnlijk, zeker in zuur milieu.
Het Ph-NH.-radicaal heeft een resonantiestructuur met een ongepaard elektron op de parapositie (zelfde idee als hierboven beschreven, maar nu de elektronenparen niet doorschuiven maar splitsen). Dit radicaal kan reageren met een ander Ph-NH.-radicaal.
Het stikstofatoom van de aminegroep kan zijn elektronenpaar de ring insturen; dit geeft een resonantiestructuur met een positieve lading op de stikstof en een negatieve lading op de parapositie.
Ik vermoed dat de aminogroep eerst aanvalt op de -O-O- binding van peroxodisulfaat. Dat kan, omdat deze binding zeer labiel is. Vervolgens vindt homolytische splitsing van de N+-O binding plaats. Waarschijnlijk is de SO4. groep ook verantwoordelijk voor deprotonering van de aminefunctie.
Deprotonering als eerste stap lijkt me onwaarschijnlijk, zeker in zuur milieu.
Het Ph-NH.-radicaal heeft een resonantiestructuur met een ongepaard elektron op de parapositie (zelfde idee als hierboven beschreven, maar nu de elektronenparen niet doorschuiven maar splitsen). Dit radicaal kan reageren met een ander Ph-NH.-radicaal.