[scheikunde] Kalkgehalte in eierschalen bepalen
Moderators: ArcherBarry, Fuzzwood
-
- Berichten: 31
[scheikunde] Kalkgehalte in eierschalen bepalen
Hoi
Wij, 2 scholieren van vwo 6, moeten een scheikunde praktische opdracht maken over het kalkgehalte in eierschalen.
Dit moeten wij doormiddel van titraties doen.
De opdracht luidt
Doormiddel van een acidimetrische (zuur-base) titratie van het carbonaat-ion en een complexometrische titratie van het calcium-ion moeten we het kalkgehalte bepalen van eierschalen. De bepaling van de zuur base titratie kun je het beste uitvoeren middels een terugtitratie.
We moeten een werkplan maken, van beide titratie manieren.
Maar hebben geeeeeeen idee hoe dit moet en ook geen idee welke reactie vergelijkingen/berekeningen we uit moeten voeren.
Hulp zou erg erg erg fijn zijn!
Groetjes.
Wij, 2 scholieren van vwo 6, moeten een scheikunde praktische opdracht maken over het kalkgehalte in eierschalen.
Dit moeten wij doormiddel van titraties doen.
De opdracht luidt
Doormiddel van een acidimetrische (zuur-base) titratie van het carbonaat-ion en een complexometrische titratie van het calcium-ion moeten we het kalkgehalte bepalen van eierschalen. De bepaling van de zuur base titratie kun je het beste uitvoeren middels een terugtitratie.
We moeten een werkplan maken, van beide titratie manieren.
Maar hebben geeeeeeen idee hoe dit moet en ook geen idee welke reactie vergelijkingen/berekeningen we uit moeten voeren.
Hulp zou erg erg erg fijn zijn!
Groetjes.
- Berichten: 11.177
Re: [scheikunde] Kalkgehalte in eierschalen bepalen
Hoe zou carbonaat volgens jou met een zuur reageren?
Voor het calciumgehalte verwijs ik je graag naar een voorschrift die EDTA met erio-T black als indicator behandelt.
Voor het calciumgehalte verwijs ik je graag naar een voorschrift die EDTA met erio-T black als indicator behandelt.
- Berichten: 421
Re: [scheikunde] Kalkgehalte in eierschalen bepalen
Wat vaak helpt is je probleem te verdelen in kleine simpele vragen.
Wat is titratie?
Wat is een zuur-base titratie? (staat vast wel op wikipedia)
Wat is een carbonaat-ion?
Waar bestaat kalk uit?
Zoiets...
Wat is titratie?
Wat is een zuur-base titratie? (staat vast wel op wikipedia)
Wat is een carbonaat-ion?
Waar bestaat kalk uit?
Zoiets...
-
- Berichten: 94
Re: [scheikunde] Kalkgehalte in eierschalen bepalen
Ik heb maar 1 ding te zeggen: Google is your friend! All smart people use google! 
Zoek eens op terugtitratie en op acid carbonate (misschien zelfs reaction erbij), dat zal vast wel een aantal hits geven wat jullie verder zullen helpen. Zoek ook bij voorkeur met engelse zoekwoorden en op engelse sites, daar zit meer bruikbaars tussen dan bij nederlandse sites.
Zoek eens op terugtitratie en op acid carbonate (misschien zelfs reaction erbij), dat zal vast wel een aantal hits geven wat jullie verder zullen helpen. Zoek ook bij voorkeur met engelse zoekwoorden en op engelse sites, daar zit meer bruikbaars tussen dan bij nederlandse sites.
-
- Berichten: 31
Re: [scheikunde] Kalkgehalte in eierschalen bepalen
Ik ben druk aan het zoeken op engelse sites, maar bij elke site nemen ze wel weer een ander zuur. Wat is het beste zuur dat je hiervoor gebruikt?
Ook probeer ik te zoeken wat EDTA precies inhoudt omdat we dit inderdaad ook voor de complexometrische titratie moeten gebruiken, maar alle teksten kan ik niet goed begrijpen.
Scheikunde is niet mijn sterkste vak en deze praktische opdracht is voor mij al een hele opgave, ook omdat zuren en basen mijn slechtste onderwerp is, vervelend.
Oke we moeten dus twee werkplannen maken.
1. zuur-base titratie
met zwavelzuur???? dit moet nog wel te doen zijn denk ik.
2. complexometrische titratie door middel van de titer EDTA?
Hoe voer je dit precies uit? Het heeft met metaal-ionen te maken en zover kom ik ongeveer.
Ook probeer ik te zoeken wat EDTA precies inhoudt omdat we dit inderdaad ook voor de complexometrische titratie moeten gebruiken, maar alle teksten kan ik niet goed begrijpen.
Scheikunde is niet mijn sterkste vak en deze praktische opdracht is voor mij al een hele opgave, ook omdat zuren en basen mijn slechtste onderwerp is, vervelend.
Oke we moeten dus twee werkplannen maken.
1. zuur-base titratie
met zwavelzuur???? dit moet nog wel te doen zijn denk ik.
2. complexometrische titratie door middel van de titer EDTA?
Hoe voer je dit precies uit? Het heeft met metaal-ionen te maken en zover kom ik ongeveer.
Re: [scheikunde] Kalkgehalte in eierschalen bepalen
Google eens op ""calciumcarbonaat titreren" dat levert genoeg links op om verder te komen.
-
- Berichten: 31
Re: [scheikunde] Kalkgehalte in eierschalen bepalen
heb alles nagelezen, kom nog niet echt verder.
Zie het verschil ook niet in tussen een complexometrische en een zuur-base, aah ik word er gek van zeg, voel me dom.
Zie het verschil ook niet in tussen een complexometrische en een zuur-base, aah ik word er gek van zeg, voel me dom.
Re: [scheikunde] Kalkgehalte in eierschalen bepalen
CaCO3 + H2SO4 --> ???
Begin eens met deze reactievergelijking op te zetten.
Begin eens met deze reactievergelijking op te zetten.
-
- Berichten: 94
Re: [scheikunde] Kalkgehalte in eierschalen bepalen
frili schreef: Ook probeer ik te zoeken wat EDTA precies inhoudt omdat we dit inderdaad ook voor de complexometrische titratie moeten gebruiken, maar alle teksten kan ik niet goed begrijpen.
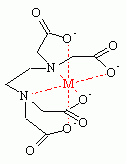
EDTA is de bovenstaande stof. M in dit plaatje is het metaalion. De EDTA is een complex dat metaalionen stabiliseert en daarbij een paarse kleur vormt onder invloed van ErioT.
Je druppelt enkele druppeltjes erioT en de EDTA in je calciumcarbonaat-oplossing waarna je vervolgens begint te titreren met bijvoorbeeld zoutzuur. CaCl lost goed op en blijft daarom in ionvorm in de oplossing zitten. Het EDTA-complex ontstaat tijdens het toedruppelen van het zoutzuur, waardoor er een paarse kleuromslag te zien is door de kleurstof ErioT. Als deze kleuromslag langer dan 20 seconden aanwezig blijft, heb je het eindpunt van je titratie bereikt en kan je door middel van de hoeveelheid zuur die je toegevoegd hebt uitrekenen hoeveel calciumcarbonaat er in je oplossing aanwezig was.
-
- Berichten: 31
Re: [scheikunde] Kalkgehalte in eierschalen bepalen
Wauw dit helpt wel al heel erg, ik zie het nu ook voor me. Bedankt!
Gerard, nu ik weet dat zoutzuur voor de complexometrische manier handig is. Is zwavelzuur het beste voor de zuur-base titratie? En hoe doe je dit precies met de terugtitratie?
H2SO4 + CaCO3 --> CaSO4 + H2O + CO2
Ik vond dit net even op wikipedia.
De bepaling van het carbonaatgehalte in soda of kalk kan met behulp van een zuur-base titratie. Het carbonaat-ion treedt hierbij op als base, doorgaans wordt zoutzuur gebruikt als titrant. De reactie zou aanleiding geven tot een zure eind-pH, dicht tegen de waarde van het gebruikte zoutzuur zelf. Door eerst het carbonaat te laten reageren met een bekende, te grote, hoeveelheid zoutzuur, en de overmaat vervolgens met natronloog te bepalen met fenolftaleine als indicator wordt een snelle en eenduidige bepaling gerealiseerd.
Reactievergelijking zoutzuur met calciumcarbonaat
CaCO3(s) + 2 HCl(aq) --> CaCl2(aq) + CO2(g) + H2O(l)
Wat eigenlijk mijn antwoord al is, stom.
maar ik ben alsnog wel benieuwd of dit ook met zwavelzuur kan?
Gerard, nu ik weet dat zoutzuur voor de complexometrische manier handig is. Is zwavelzuur het beste voor de zuur-base titratie? En hoe doe je dit precies met de terugtitratie?
H2SO4 + CaCO3 --> CaSO4 + H2O + CO2
Ik vond dit net even op wikipedia.
De bepaling van het carbonaatgehalte in soda of kalk kan met behulp van een zuur-base titratie. Het carbonaat-ion treedt hierbij op als base, doorgaans wordt zoutzuur gebruikt als titrant. De reactie zou aanleiding geven tot een zure eind-pH, dicht tegen de waarde van het gebruikte zoutzuur zelf. Door eerst het carbonaat te laten reageren met een bekende, te grote, hoeveelheid zoutzuur, en de overmaat vervolgens met natronloog te bepalen met fenolftaleine als indicator wordt een snelle en eenduidige bepaling gerealiseerd.
Reactievergelijking zoutzuur met calciumcarbonaat
CaCO3(s) + 2 HCl(aq) --> CaCl2(aq) + CO2(g) + H2O(l)
Wat eigenlijk mijn antwoord al is, stom.
maar ik ben alsnog wel benieuwd of dit ook met zwavelzuur kan?
-
- Berichten: 94
Re: [scheikunde] Kalkgehalte in eierschalen bepalen
Dit kan ook met zwavelzuur. Ik zou zelf zoutzuur gebruiken, aangezien veel chloridezouten goed oplosbaar zijn in water en dus niet storen in de vorm van een neerslag zoals CaSO4 dit zou doen (solubility = 2,1 g / L). Natuurlijk zou ik dit ook doen om de simpele reden dat dit als het normale titratiereagens gebruikt wordt.
Re: [scheikunde] Kalkgehalte in eierschalen bepalen
Ik heb denk ik nu wel een idee wat je zou kunnen doen.
Je neemt een bekende hoeveelheid gedroogde en schone eierschaal.
Los het op in een overmaat HCl.
1. Titreer in een gedeelte van de oplossing de overmaat HCl met NaOH
2. Titreer in een andere portie de calcium met EDTA.
En kijk een zuur/base reactie en een complexometrisch titratie van hetzelfde monster.
Wat betreft de zwavelzuur hierbij ontstaat onoplosbaar calciumsulfaat dat je na affiltreren en drogen kunt wegen en dan heb je ook nog een gravimetrische methode om calciumcarbonaat te bepalen.
En in je filtraat kun je natuurlijk ook een terugtitratie uitvoeren.
Je neemt een bekende hoeveelheid gedroogde en schone eierschaal.
Los het op in een overmaat HCl.
1. Titreer in een gedeelte van de oplossing de overmaat HCl met NaOH
2. Titreer in een andere portie de calcium met EDTA.
En kijk een zuur/base reactie en een complexometrisch titratie van hetzelfde monster.
Wat betreft de zwavelzuur hierbij ontstaat onoplosbaar calciumsulfaat dat je na affiltreren en drogen kunt wegen en dan heb je ook nog een gravimetrische methode om calciumcarbonaat te bepalen.
En in je filtraat kun je natuurlijk ook een terugtitratie uitvoeren.
-
- Berichten: 31
Re: [scheikunde] Kalkgehalte in eierschalen bepalen
Heel erg bedankt! Dan ga ik toch voor het HCL
Met de EDTA, je voegt de EDTA dus toe aan het calciumcarbonaat
en je titreet dit ook met NaOH in de buret? of HCL in de buret?
De eierschalen moet ook verdund worden neem ik aan, hoeveel verdund zal dit ongeveer moeten zijn? Of kan ik dit pas bepalen als ik de bekende hoeveelheden heb.
In stuk 1, wat is hier precies de terugtitratie aan?
Echt fantastisch dat jullie dit doen, helpt me heel erg.
Met de EDTA, je voegt de EDTA dus toe aan het calciumcarbonaat
en je titreet dit ook met NaOH in de buret? of HCL in de buret?
De eierschalen moet ook verdund worden neem ik aan, hoeveel verdund zal dit ongeveer moeten zijn? Of kan ik dit pas bepalen als ik de bekende hoeveelheden heb.
In stuk 1, wat is hier precies de terugtitratie aan?
Echt fantastisch dat jullie dit doen, helpt me heel erg.
Re: [scheikunde] Kalkgehalte in eierschalen bepalen
Kom op Frida, wel bij de les blijven.
Je eerste reactie (zie boven):
CaCO3(s) + 2 HCl(aq) --> CaCl2(aq) + CO2(g) + H2O(l)
Nadat je eierschalen opgelost zijn, de oplossing goed verwarmen om alle CO2 te verdrijven anders klopt je terugtitratie niet.
Met overmaat HCl wat zit er dan in je reactievat als je met de titraties begint?
Je eerste reactie (zie boven):
CaCO3(s) + 2 HCl(aq) --> CaCl2(aq) + CO2(g) + H2O(l)
Nadat je eierschalen opgelost zijn, de oplossing goed verwarmen om alle CO2 te verdrijven anders klopt je terugtitratie niet.
Met overmaat HCl wat zit er dan in je reactievat als je met de titraties begint?
-
- Berichten: 31
Re: [scheikunde] Kalkgehalte in eierschalen bepalen
volgens mij mis ik iets haha, ook nog verwarmen.
uhm je CO2 is verdwenen dus je houdt nog CaCl2 en H2O over?
Geloof me ik mis alles qua zuren en basen.
uhm je CO2 is verdwenen dus je houdt nog CaCl2 en H2O over?
Geloof me ik mis alles qua zuren en basen.