Nee, deze tekening is helaas niet goed.
Je moet goed begrijpen dat er (binnen de normale moleculen) 4 verschillende soorten orbitalen bestaan, de s, p, d en f orbitalen.
De hoeveelheid elektronen die voorkomen in deze orbitalen zijn als volgt:
s=2
p=6
d=10
f=14
Dus een elektronenbaan/orbitaal met 8 elektronen kan officieel niet.
Als je nu wilt weten in welke volgorde deze banen zijn gerangschikt kun je gebruik maken van mijn onderstaande plaatje:
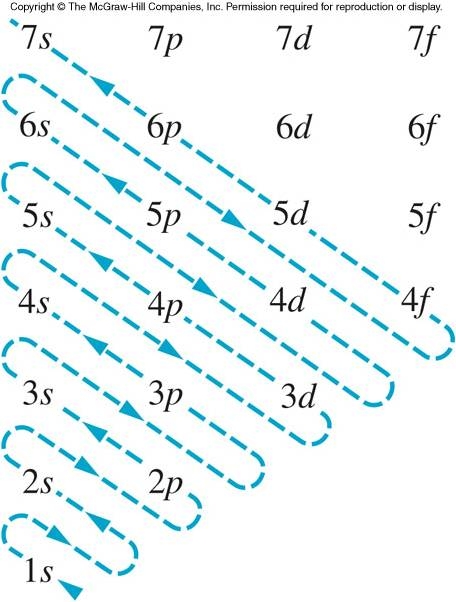
Deze laat zien dat de vaste volgorde voor de orbitalen 1s,2s,2p,3s,3p,4s,3d etc. is.
Als je kijkt hoeveel elektronen in de s,p en d orbitalen zitten is dit dus: 2+2+6+2+6+2+10 etc. Dit is samen 30 elektronen.
Een normaal ijzer atoom heeft 26 elektronen. Dus de orbitalen 1s,2s,2p,3s,3p en 4s zijn verzadigd. Dat is samen 20 dus kom je nog 6 te kort die moeten in het 3d orbitaal worden verwerkt (dat 10 elektronen kan bevatten).
Echter hebben we hier te maken met ijzer 3PLUS dus zijn er 3 elektronen minder en dus bevat deze buitenste baan geen 6 maar 3 elektronen.
Nu kun je de banen dus gaan tekenen.
IJzer3 heeft dus 7 banen om zich heen waarvan de buitenste baan 3 elektronen bevat.
Dit aantal is ook aan te geven met het aantal bindingen dat een atoom aan kan gaan. Dit is weergegeven in onderstaand plaatje.





