bi-ampèrometrie
Moderator: ArcherBarry
-
- Berichten: 14
bi-amp
Bij het studeren van het hoofdstuk ampèrometrie zit ik vast ter hoogte van bi-ampérometrie. Blijkbaar heb je 2 mogelijkheden in verband met het redoxkoppel namelijk een reversibel redox koppel waarbij E1/2(OX1) = E 1/2 (Red1) en een irreversibel koppel waarbij deze niet gelijk zijn aan elkaar.
Het verschil tussen beiden begrijp ik echter niet zo goed, bovendien kan ik de grafiek van een irreversibel redoxsysteem niet verklaren. Kan iemand mij helpen ? Op internet vind ik niet meteen iets bruikbaar.
Alvast bedankt voor de moeite
Het verschil tussen beiden begrijp ik echter niet zo goed, bovendien kan ik de grafiek van een irreversibel redoxsysteem niet verklaren. Kan iemand mij helpen ? Op internet vind ik niet meteen iets bruikbaar.
Alvast bedankt voor de moeite
-
- Berichten: 723
Re: bi-amp
Je kan een redox-reactie (en elke andere reactie) analytisch voorstellen door je reactie vergelijking:
M --> Mn+ + ne-
Deze reactievergelijking zegt echter niets over de snelheid waarmee dit evenwicht wordt ingesteld. Het zou dus kunnen dat de reductie, sneller verloopt dan de oxidatie (of omgekeerd uiteraard). Dit kan afkomstig zijn van afscherming van de elektronen bijvoorbeeld. Dit treedt op bij Cr2O72-. De reductie (vorming Cr(III+)) is trager dan de oxidatie (vorming Cr(VI+) (kan ook omgekeerd zijn ). Aldus zal er een "reactie-overpotentiaal" ontstaan, waardoor de E0 waarde van de oxidatie/reductie verschuift naar hogere of respectievelijk lagere waarde. Het gevolg is dat je halfwaarde potentiaal voor je reductie en oxidatie dus niet gelijk is (want je E0 waarde is anders en deze is vervat in je halfwaarde potentiaal).
). Aldus zal er een "reactie-overpotentiaal" ontstaan, waardoor de E0 waarde van de oxidatie/reductie verschuift naar hogere of respectievelijk lagere waarde. Het gevolg is dat je halfwaarde potentiaal voor je reductie en oxidatie dus niet gelijk is (want je E0 waarde is anders en deze is vervat in je halfwaarde potentiaal).
Bij reversibele systemen, zoals de reductie en oxidatie van Fe3+ en Fe2+, zijn beide reacties wel evensnel waardoor er geen overpotentiaal ontstaat.
Grafische krijg je dit: links reversivel: halfwaarde potentiaal is gelijk, rechts iriversiebel, halfwaarde potentiaal niet gelijk:
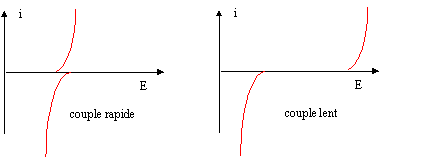
Hopelijk verduidelijkt dit je probleem een beetje .
.
EDIT: figuurtje gevonden
M --> Mn+ + ne-
Deze reactievergelijking zegt echter niets over de snelheid waarmee dit evenwicht wordt ingesteld. Het zou dus kunnen dat de reductie, sneller verloopt dan de oxidatie (of omgekeerd uiteraard). Dit kan afkomstig zijn van afscherming van de elektronen bijvoorbeeld. Dit treedt op bij Cr2O72-. De reductie (vorming Cr(III+)) is trager dan de oxidatie (vorming Cr(VI+) (kan ook omgekeerd zijn
Bij reversibele systemen, zoals de reductie en oxidatie van Fe3+ en Fe2+, zijn beide reacties wel evensnel waardoor er geen overpotentiaal ontstaat.
Grafische krijg je dit: links reversivel: halfwaarde potentiaal is gelijk, rechts iriversiebel, halfwaarde potentiaal niet gelijk:

Hopelijk verduidelijkt dit je probleem een beetje
EDIT: figuurtje gevonden