Aspirine redox titratie
Moderator: ArcherBarry
Forumregels
(Middelbare) school-achtige vragen naar het forum "Huiswerk en Practica" a.u.b.
Zie eerst de Huiswerkbijsluiter
(Middelbare) school-achtige vragen naar het forum "Huiswerk en Practica" a.u.b.
Zie eerst de Huiswerkbijsluiter
-
- Berichten: 493
Aspirine redox titratie
Een vraag.
Is het mogelijk om mbv een redoxtitratie, met Ce4+ als reductor, acetylsalicylzuur te titreren.
Zo ja,
-Reageert dan de zuur groep van aspirine tot een aldehyde groep. Of kan deze zelfs nog tot
een alcohol groep gereduceerd worden.
-Is er dan weinig of veel (zwavel)zuur nodig om de oxidatie reactie van aspirine te kunnen laten
verlopen. (Heb wel eens mohr's zout getitreerd mbv Ce4+ oplossing in 2M H2SO4.)
-En is feroine geschikt als redox indicator.
Is het mogelijk om mbv een redoxtitratie, met Ce4+ als reductor, acetylsalicylzuur te titreren.
Zo ja,
-Reageert dan de zuur groep van aspirine tot een aldehyde groep. Of kan deze zelfs nog tot
een alcohol groep gereduceerd worden.
-Is er dan weinig of veel (zwavel)zuur nodig om de oxidatie reactie van aspirine te kunnen laten
verlopen. (Heb wel eens mohr's zout getitreerd mbv Ce4+ oplossing in 2M H2SO4.)
-En is feroine geschikt als redox indicator.
- Berichten: 227
Re: Aspirine redox titratie
en wat ga je oxideren aan de aspirine? In ieder geval niet de reductie naar een aldehyde/alcohol.
-
- Berichten: 493
Re: Aspirine redox titratie
Wilde mbv titratie bepalen hoe zuiver een eigengemaakte acetylsalycilzuur is.
Ik had gedacht dat dit wellicht via een redox titratie kon.
Dmv verzeping van acetylsalycilzuur naar salicylzuur, zou dit via een zuur base reactie kunnen.
De ene carbonzuur groep zal mijns inziens niets doen. Maar wellicht de ester groep wel.
Ik had gedacht dat dit wellicht via een redox titratie kon.
Dmv verzeping van acetylsalycilzuur naar salicylzuur, zou dit via een zuur base reactie kunnen.
De ene carbonzuur groep zal mijns inziens niets doen. Maar wellicht de ester groep wel.
- Berichten: 227
Re: Aspirine redox titratie
eigengemaakte acetylsalycilzuur? Vanuit waar ben je dan gekomen? Ik neem aan dat je dan alleen de phenol groep geacetyleerd hebt? Of heb je de hele synthese gedaan. (lijkt me praktisch onmogelijk, of heb je het geisolleerd uit een boom ofzo?) Ik begrijp in ieder geval niet wat je wil doen met een verzeping van de ester.
Bovendien zie ik niet in waarom je de acetyl-vorm wel en de vrije vrom niet zou oxideren. In beide gevallen oxideer je ze volledig.
//er zit wel iets in, zie mijn post hieronder
Bovendien zie ik niet in waarom je de acetyl-vorm wel en de vrije vrom niet zou oxideren. In beide gevallen oxideer je ze volledig.
//er zit wel iets in, zie mijn post hieronder
- Berichten: 11.177
Re: Aspirine redox titratie
Je kunt technisch gezien vanuit fenol beginnen hoor, desnoods van benzeen die je nitreert, reduceert, en sandmeyert tot fenol. Daarna base erbij, CO2 inleiden en klaar is je salicylaat.
- Berichten: 227
Re: Aspirine redox titratie
theoretisch gezien wel, maar op labschaal toch redelijk complex zou ik zeggen. In ieder geval geen stappen die je in je kolfje even uitvoert. Sowieso die laatste stap met co2 gebeurt bij hoge druk (en +100 graden). Dus zo klaar lijkt me toch niet helemaal het geval.
Meestal zie je bij dit soort proeven wanneer ze aspirin maken dat ze alleen het salicylzuur acetyleren..
Even terugkijkend denk ik dat het wel mogelijk moet zijn om de phenolvorm makkelijker aan te tonen. Die oxideert denk ik een stuk sneller dan de geacetyleerde variant.
Meestal zie je bij dit soort proeven wanneer ze aspirin maken dat ze alleen het salicylzuur acetyleren..
Even terugkijkend denk ik dat het wel mogelijk moet zijn om de phenolvorm makkelijker aan te tonen. Die oxideert denk ik een stuk sneller dan de geacetyleerde variant.
-
- Berichten: 493
Re: Aspirine redox titratie
Dank voor de reacties. Al begrijp ik ze niet helemaal.
Maar:
Heb acetylsalycilzuur gemaakt dmv azijnzuuranhydride met salicylzuur te laten reageren. Met zwavelzuur als katalysator. Volgens voorschrift uit boek van Arthur I. Vogel.
Maar:
Heb acetylsalycilzuur gemaakt dmv azijnzuuranhydride met salicylzuur te laten reageren. Met zwavelzuur als katalysator. Volgens voorschrift uit boek van Arthur I. Vogel.
- Berichten: 227
Re: Aspirine redox titratie
precies.. Je hebt dus de phenol groep geacetyleerd. Dat is dus zoals ik dacht de laatste stap in de synthese van aspirine. De zuiverheid zullen ze bedoelen hoeveel beginstof je aan het eind nog over hebt.
Ik denk inderdaad dat dat mnet een titratie moet kunnen. De uitgangstof (met de phenolgroep) zal denk ik eerder oxideren dan de geacetyleerde variant
Ik denk inderdaad dat dat mnet een titratie moet kunnen. De uitgangstof (met de phenolgroep) zal denk ik eerder oxideren dan de geacetyleerde variant
-
- Berichten: 493
Re: Aspirine redox titratie
Kunt u mij ook vertellen hoe de oxidatie reactie dan precies verloopt.
Ofwel welk produkt ontstaat er dan eigenlijk?
Welke reactieverhouding is er dan?
Ofwel welk produkt ontstaat er dan eigenlijk?
Welke reactieverhouding is er dan?
- Berichten: 227
Re: Aspirine redox titratie
Tja.. Bij oxidaties krijg je vaak wel meer producten gevormd, maar ik zou zeggen zoiets als het idee van een quinon-structuur. Ik vraag me alleen of af of je er echt iets mee kunt.
Die verzeping-methode zou ook wel eens een goede methode kunnen zijn. Ik heb het nooit gedaan, maar genoeg voorbeelden.
http://mccord.cm.utexas.edu/courses/fall20...455/aspirin.pdf
Die verzeping-methode zou ook wel eens een goede methode kunnen zijn. Ik heb het nooit gedaan, maar genoeg voorbeelden.
http://mccord.cm.utexas.edu/courses/fall20...455/aspirin.pdf
-
- Berichten: 493
Re: Aspirine redox titratie
Allereerst dank voor uw link, deze is erg verhelderend.
Echter wat is een quinon-structuur?
Echter wat is een quinon-structuur?
- Berichten: 227
Re: Aspirine redox titratie
zoiets als.toaic schreef: Allereerst dank voor uw link, deze is erg verhelderend.
Echter wat is een quinon-structuur?
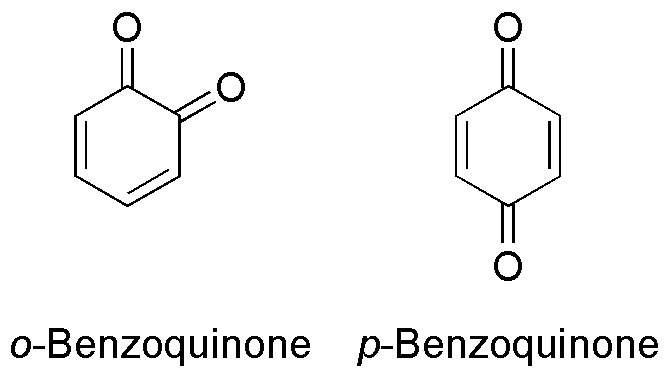 maar dan gesubstitueerd, maar ik moet zeggen dat ik ook niet helemaal kan voorspellen hoe precies
maar dan gesubstitueerd, maar ik moet zeggen dat ik ook niet helemaal kan voorspellen hoe precies