Zou iemand mij kunnen uitleggen waarom men bij het bepalen van de zuurtegraad van de oplossing de reactie met de grootste evenwichtskonstante neemt en niet die met de kleinste waarde?
Het volgend voorbeeld:
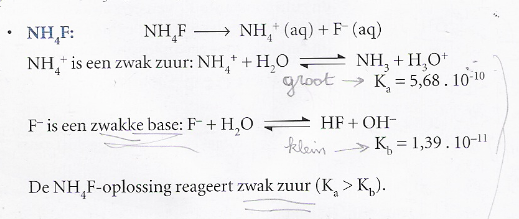
Ik zou zeggen dat men juist de kleinste waarde moet nemen. Omdat kleinst betekent dat het evenwicht meer naar links ligt dus zullen er meer F-ionen zijn dan amonium-ionen en dat is wat we nodig hebben.
Dank bij voorbaat.