[scheikunde] Geometrie bepalen
Moderators: ArcherBarry, Fuzzwood
-
- Berichten: 33
Geometrie bepalen
Hallo,
Wij hebben in een oefenig telkens de geometrie van een molecule erbij gezet. Er staat geen uitleg bij, het wordt gewoon telkens op het einde van de oefening vermeld..
Maar ik snap niet hoe je dat ziet? Bij moleculen zoals CO2 of H2O dan weet je dat uit je hoofd, maar HCl2O2 vb, daar kan ik niet zo meteen zeggen wat de geometrie gaat zijn...
Danku
Wij hebben in een oefenig telkens de geometrie van een molecule erbij gezet. Er staat geen uitleg bij, het wordt gewoon telkens op het einde van de oefening vermeld..
Maar ik snap niet hoe je dat ziet? Bij moleculen zoals CO2 of H2O dan weet je dat uit je hoofd, maar HCl2O2 vb, daar kan ik niet zo meteen zeggen wat de geometrie gaat zijn...
Danku
- Berichten: 3.963
Re: Geometrie bepalen
Heb je de VSEPR theorie gezien? Weet je wat een sterisch getal is?
"Success is the ability to go from one failure to another with no loss of enthusiasm" - Winston Churchill
-
- Berichten: 33
Re: Geometrie bepalen
Ja...
Alhoewel nee, ik snap nog altijd niet goed hoe je het sterisch getal moet afleiden.. Is dat gewoon het aantal bindingen?
Alhoewel nee, ik snap nog altijd niet goed hoe je het sterisch getal moet afleiden.. Is dat gewoon het aantal bindingen?
- Berichten: 3.963
Re: Geometrie bepalen
Het sterisch getal bepaal je door de som te nemen van het het aantal bindingspartners en het aantal vrije elektronenparen rond een atoom.
Bijv.:
 Bron: Wikipedia.de
Koolstof heeft twee bindingspartners (één zuurstof rechts en één zuurstof links) en geen vrije elektronenparen. Bijgevolg is het sterisch getal 2 en heb je te maken met een lineaire molecule.
Bron: Wikipedia.de
Koolstof heeft twee bindingspartners (één zuurstof rechts en één zuurstof links) en geen vrije elektronenparen. Bijgevolg is het sterisch getal 2 en heb je te maken met een lineaire molecule.
Merk dus op dat het sterisch getal van een atoom helemaal kan verschillen aantal bindingen dat dit atoom aangaat.
Merk ook op dat steeds over een correcte lewis-structuur moet beschikken om het sterisch getal te kunnen bepalen.
Probeer nu eens zelf voor HClO2.
Bijv.:
Merk dus op dat het sterisch getal van een atoom helemaal kan verschillen aantal bindingen dat dit atoom aangaat.
Merk ook op dat steeds over een correcte lewis-structuur moet beschikken om het sterisch getal te kunnen bepalen.
Probeer nu eens zelf voor HClO2.
"Success is the ability to go from one failure to another with no loss of enthusiasm" - Winston Churchill
-
- Berichten: 33
Re: Geometrie bepalen
Dus Cl heeft 3 bindingspartners en 2 vrije elektronenparen dus sterisch getal is 5?
- Berichten: 3.963
Re: Geometrie bepalen
Dat klopt niet, teken eens de lewis-structuur.
HClO2 is een oxozuur, je mag er dus van uitgaan dat het H-atoom gebonden is op een zuurstofatoom.
HClO2 is een oxozuur, je mag er dus van uitgaan dat het H-atoom gebonden is op een zuurstofatoom.
"Success is the ability to go from one failure to another with no loss of enthusiasm" - Winston Churchill
-
- Berichten: 33
Re: Geometrie bepalen
En hoe weet je dat dan? Of moet je dat vanbuiten leren? Dan kom ik nog op 2 bindingspartners? Dus sp dan?
Ik snap het niet echt :s
Bij lewisformule dat ik dat Cl centrale atoom is, dan heb je eronder O (dubbel gebonden) en dan een OH aan de rechterkant.
Ik snap het niet echt :s
Bij lewisformule dat ik dat Cl centrale atoom is, dan heb je eronder O (dubbel gebonden) en dan een OH aan de rechterkant.
- Berichten: 3.963
Re: Geometrie bepalen
Dat klopt, zoiets dus:Mich789 schreef: ↑zo 27 jan 2013, 21:34
Bij lewisformule dat ik dat Cl centrale atoom is, dan heb je eronder O (dubbel gebonden) en dan een OH aan de rechterkant.
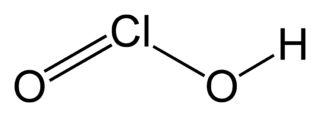 Bron: Wikipedia.nl
Bron: Wikipedia.nlHoeveel vrije elektronen heeft het chlooratoom?
En kan je dan vervolgens het sterisch getal berekenen?
Kravitz schreef: ↑zo 27 jan 2013, 10:20
Het sterisch getal bepaal je door de som te nemen van het het aantal bindingspartners en het aantal vrije elektronenparen rond een atoom.
"Success is the ability to go from one failure to another with no loss of enthusiasm" - Winston Churchill