[scheikunde] Gedelokaliseerde bindingen
Moderators: ArcherBarry, Fuzzwood
-
- Berichten: 33
Gedelokaliseerde bindingen
Hallo,
ik snap niet goed hoe je weet dat je gedelokaliseerde bindingen zal hebben?
Vb CH3- CH = CH2
Waarom heb je hier vb geen gedelokaliseerde bindingen en in
CH3COO wel?
danku
ik snap niet goed hoe je weet dat je gedelokaliseerde bindingen zal hebben?
Vb CH3- CH = CH2
Waarom heb je hier vb geen gedelokaliseerde bindingen en in
CH3COO wel?
danku
- Berichten: 15
Re: Gedelokaliseerde bindingen
CH3COO: je hebt hier te maken met een gedelokaliseerde Pi-binding,
Bij covalente bindingen bestaan er 2 soorten verbindingen:
Sigma-binding (vb enkelvoudige binding: S-orbitaal overlap)
Pi-binding ( bij een dubbele binding, driedubbele binding, P- en D- orbitaal overlap)
Wanneer kan aangetoond worden dat de bindingslengten van een binding niet overeenkomt met de werkelijkheid, kan dit worden aangetoond door resonantiestructuren (kanonieken)
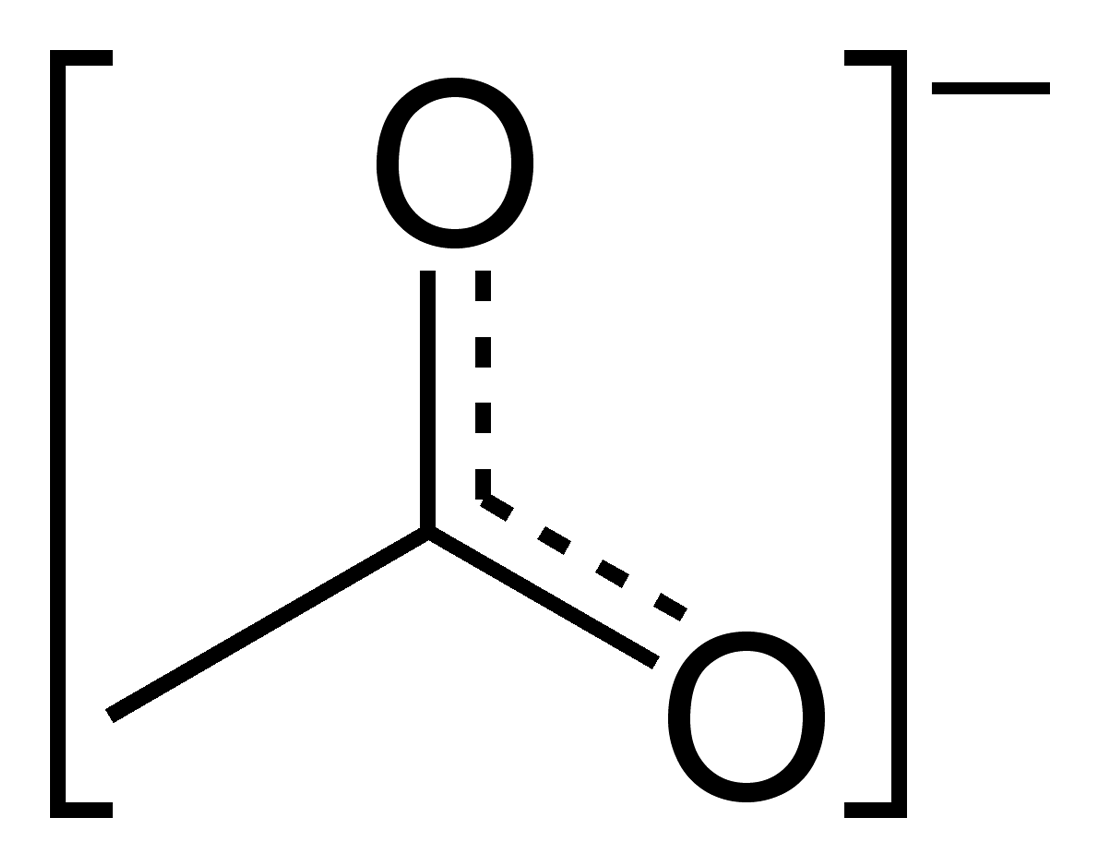
voor CH3COO- is dit dus:

Dit wil simpelweg zeggen dat de dubbele binding zowel bij de ene O als bij de andere O kan zitten. Je kan dit weergeven als :
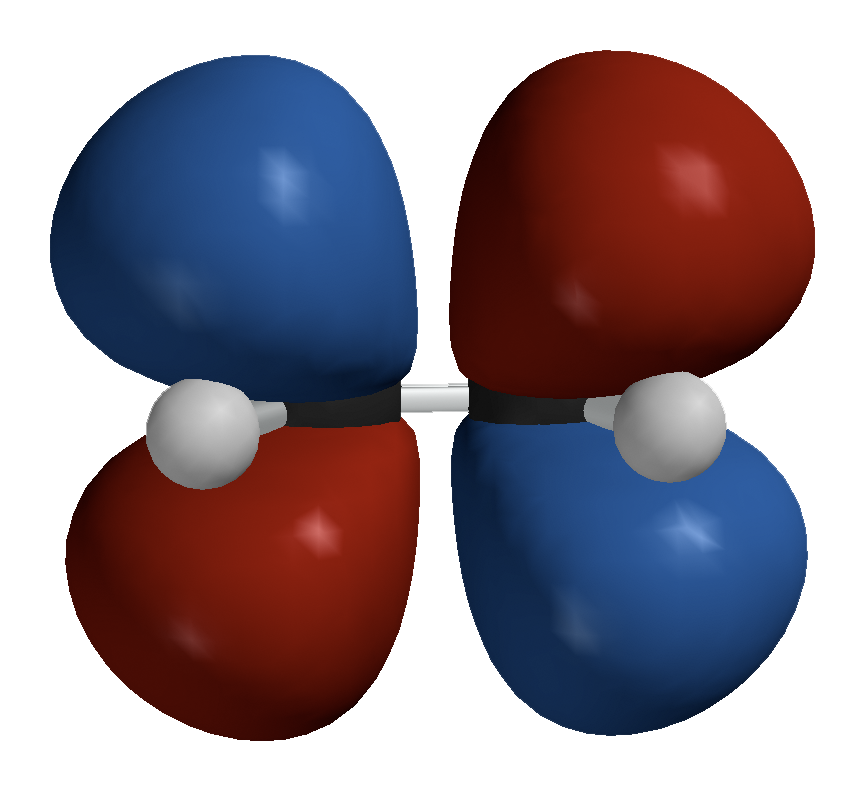
De molecuul-orbitaal theorie is hier de verklaring voor: wanneer atomen zich gaan binden tot een molecuul, gaan ook de orbitalen overlappen. Een Pi-binding is dus eigenlijk het gevolg van een overlap tussen P- en D- orbitalen.
We spreken wel enkel van een gedelokaliseerde Pi-binding wanneer verscheidene resonantiestructuren mogelijk zijn (dus wanneer de dubbele binding zich zowel op de ene als op de andere plaats kan bevinden)
Bij covalente bindingen bestaan er 2 soorten verbindingen:
Sigma-binding (vb enkelvoudige binding: S-orbitaal overlap)
Pi-binding ( bij een dubbele binding, driedubbele binding, P- en D- orbitaal overlap)
Wanneer kan aangetoond worden dat de bindingslengten van een binding niet overeenkomt met de werkelijkheid, kan dit worden aangetoond door resonantiestructuren (kanonieken)
voor CH3COO- is dit dus:

Dit wil simpelweg zeggen dat de dubbele binding zowel bij de ene O als bij de andere O kan zitten. Je kan dit weergeven als :

De molecuul-orbitaal theorie is hier de verklaring voor: wanneer atomen zich gaan binden tot een molecuul, gaan ook de orbitalen overlappen. Een Pi-binding is dus eigenlijk het gevolg van een overlap tussen P- en D- orbitalen.

We spreken wel enkel van een gedelokaliseerde Pi-binding wanneer verscheidene resonantiestructuren mogelijk zijn (dus wanneer de dubbele binding zich zowel op de ene als op de andere plaats kan bevinden)
- Berichten: 2.455
Re: Gedelokaliseerde bindingen
Even voor de duidelijkheid:
En tot slot: het orbitaal-figuurtje toont de antibindende orbitalen, en niet de de bindende. Maar dit drijft ons te ver en is niet noodzakelijk om de vraag van de TS te beantwoorden.
maar in de gegeven voorbeelden alleen van p-orbitalen onderling.Een Pi-binding is dus eigenlijk het gevolg van een overlap tussen P- en D- orbitalen.
Belangrijk om te vermelden dat het hier dan niet gaat over "de dubbele binding zit een deel van de tijd hier, en een dele van de tijd daar". De echte structuur is een (gewogen) gemiddelde van de resonantie-structuren, de elektronen verantwoordelijk voor de dubbele binding(en) zijn dus verspreid over een groter gebied dan twee atomen alleen.
We spreken wel enkel van een gedelokaliseerde Pi-binding wanneer verscheidene resonantiestructuren mogelijk zijn (dus wanneer de dubbele binding zich zowel op de ene als op de andere plaats kan bevinden)
En tot slot: het orbitaal-figuurtje toont de antibindende orbitalen, en niet de de bindende. Maar dit drijft ons te ver en is niet noodzakelijk om de vraag van de TS te beantwoorden.
This is weird as hell. I approve.