[scheikunde] De pH berekenen met concentratie H3O+ en OH-
Moderators: ArcherBarry, Fuzzwood
- Berichten: 6
De pH berekenen met concentratie H3O+ en OH-
Mijn vragen zijn
*stel ik heb een concentratie [H30+] van 5,0.10^-6 hoe bereken ik de PH ?
*stel ik heb een concentratie [OH-] van 2,0.10^-5 hoe bereken ik de PH?
*stel ik krijg PH=4,30 gegeven hoe bereken ik [H3O+] en pOH ?
*stel ik krijg pOH= 4,32 gegeven hoe bereken ik [OH-] en pH ?
Ik vind dit nog al verwarrend...
en nu heb ik nog deze vraag : Een bacterie heeft een cilindervorm met diameter 1,0 µm en lengte 2,0 µm. De bacterie bevat 80 volume% water. De PH van het celvocht is 6,40. Bereken het aantal H3O+ ionen in 1 cel. oplossing is 3,0.10^2 ionen
alvast bedankt
*stel ik heb een concentratie [H30+] van 5,0.10^-6 hoe bereken ik de PH ?
*stel ik heb een concentratie [OH-] van 2,0.10^-5 hoe bereken ik de PH?
*stel ik krijg PH=4,30 gegeven hoe bereken ik [H3O+] en pOH ?
*stel ik krijg pOH= 4,32 gegeven hoe bereken ik [OH-] en pH ?
Ik vind dit nog al verwarrend...
en nu heb ik nog deze vraag : Een bacterie heeft een cilindervorm met diameter 1,0 µm en lengte 2,0 µm. De bacterie bevat 80 volume% water. De PH van het celvocht is 6,40. Bereken het aantal H3O+ ionen in 1 cel. oplossing is 3,0.10^2 ionen
alvast bedankt
- Berichten: 3.963
Re: De pH berekenen met concentratie H3O+ en OH-
Laten we beginnen met je eerste vragen, weet je hoe je de pH berekent?
Wat is de pH? Welke formule gebruik je? (Dat zou zeker in je cursus en/of boek moeten staan)
Wat is de pH? Welke formule gebruik je? (Dat zou zeker in je cursus en/of boek moeten staan)
"Success is the ability to go from one failure to another with no loss of enthusiasm" - Winston Churchill
- Berichten: 6
Re: De pH berekenen met concentratie H3O+ en OH-
-log [H30+] maar in mijn cursus staat bij [H3O+] = 5.10^-6 als uitkomst PH =4 terwijl als ik -log (5.10^-6) doe op mijn ZRM krijg ik 5,30 als uitkomst voor de PH. daarom ben ik in de war 
- Pluimdrager
- Berichten: 2.722
Re: De pH berekenen met concentratie H3O+ en OH-
pH =5,30 is goed.
Dus op naar de volgende opgave.
Dus op naar de volgende opgave.
- Berichten: 6
Re: De pH berekenen met concentratie H3O+ en OH-
*stel ik heb een concentratie [OH-] van 2,0.10^-5 hoe bereken ik de PH?
-log(2,0.10^-5) = 4,70 pOH dus PH = 9,3
*stel ik krijg PH=4,30 gegeven hoe bereken ik [H3O+] en pOH ?
1.10^-4,30 = 5.10^-5 voor [H3O+] en 14-4,30 = 9,7 voor de PH
*stel ik krijg pOH= 4,32 gegeven hoe bereken ik [OH-] en pH ?
PH = 14-4,32 = 9,68
[OH-] = 10^-4,32 = 4,8.10^-5
Zit ik hier juist ??
volume cilinder = 1.10^-6 . 2.10^-6 = 2.10^-12 m^3
en voor de rest zit ik echt vast bij deze...
-log(2,0.10^-5) = 4,70 pOH dus PH = 9,3
*stel ik krijg PH=4,30 gegeven hoe bereken ik [H3O+] en pOH ?
1.10^-4,30 = 5.10^-5 voor [H3O+] en 14-4,30 = 9,7 voor de PH
*stel ik krijg pOH= 4,32 gegeven hoe bereken ik [OH-] en pH ?
PH = 14-4,32 = 9,68
[OH-] = 10^-4,32 = 4,8.10^-5
Zit ik hier juist ??
volume cilinder = 1.10^-6 . 2.10^-6 = 2.10^-12 m^3
en voor de rest zit ik echt vast bij deze...
- Berichten: 10.561
Re: De pH berekenen met concentratie H3O+ en OH-
Met de eerste 3 zit je goed. Je hebt de methodiek prima door.
Diezelfde methodiek heb je bij de vierde opgave nodig. Je hebt een volume uitgerekend. Je weet de pH. Met de pH kun je (zie de eerste 3) een bijbehorende concentratie uitrekenen. Je weet dan dus een volume en een concentratie.
Wat gevraagd is, is een hoeveelheid. Hoe zijn hoeveelheid, concentratie en volume aan elkaar gerelateerd?
Diezelfde methodiek heb je bij de vierde opgave nodig. Je hebt een volume uitgerekend. Je weet de pH. Met de pH kun je (zie de eerste 3) een bijbehorende concentratie uitrekenen. Je weet dan dus een volume en een concentratie.
Wat gevraagd is, is een hoeveelheid. Hoe zijn hoeveelheid, concentratie en volume aan elkaar gerelateerd?
Cetero censeo Senseo non esse bibendum
- Berichten: 3.963
Re: De pH berekenen met concentratie H3O+ en OH-
Als aanvulling op bovenstaande:
Slordigheden zoals hierboven hebben vaak een totaal andere betekenis! Let ook een beetje op met je notatie, het is eigenlijk pH en pOH i.p.v. PH en POH.*stel ik krijg PH=4,30 gegeven hoe bereken ik [H3O+] en pOH ?
1.10^-4,30 = 5.10^-5 voor [H3O+] en 14-4,30 = 9,7 voor de POH
Dit klopt niet. Wanneer je meter met meter vermenigvuldigd kan daar nooit m3 uitkomen.... Hoe bereken je het volume van een cilinder?
"Success is the ability to go from one failure to another with no loss of enthusiasm" - Winston Churchill
- Berichten: 6
Re: De pH berekenen met concentratie H3O+ en OH-
ja ik weet dat het steeds pOH en pH genoteerd wordt  maar ik typ het snel over van mijn blad waar ik het uitwerk daarom die foutjes...
maar ik typ het snel over van mijn blad waar ik het uitwerk daarom die foutjes...
Volume cilinder had ik totaal verkeerd =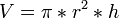
dus : pi . (0,5.10^-6 m)² . 2.10^-6 m = 1,57.10^-18 m³
dan 80% hiervan = 1,26.10^-18 m³ = 1,26.10^-18 L
Concentratie = 1.10^-6,40 = 3,98.10^-7 M of mol/L
Nu dacht ik aan de mol berekenen door Concentratie maal volume te doen , en dan mol / concentratie . liter dan zouden al mijn eenheden verdwijnen en zou ik een aantal uitkomen maar ik bekom 1 als uitkomst :/ dus hier zit ik volledig verkeerd denk ik
Volume cilinder had ik totaal verkeerd =
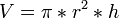
dus : pi . (0,5.10^-6 m)² . 2.10^-6 m = 1,57.10^-18 m³
dan 80% hiervan = 1,26.10^-18 m³ = 1,26.10^-18 L
Concentratie = 1.10^-6,40 = 3,98.10^-7 M of mol/L
Nu dacht ik aan de mol berekenen door Concentratie maal volume te doen , en dan mol / concentratie . liter dan zouden al mijn eenheden verdwijnen en zou ik een aantal uitkomen maar ik bekom 1 als uitkomst :/ dus hier zit ik volledig verkeerd denk ik
- Berichten: 3.963
Re: De pH berekenen met concentratie H3O+ en OH-
Dit is goed, maar bij de omzetting van m3 naar liter maak je nog een foutje.Jempi schreef: ↑za 25 mei 2013, 12:44
Volume cilinder had ik totaal verkeerd =
dus : pi . (0,5.10^-6 m)² . 2.10^-6 m = 1,57.10^-18 m³
dan 80% hiervan = 1,26.10^-18 m³ = 1,26.10^-18 L
Concentratie = 1.10^-6,40 = 3,98.10^-7 M of mol/L
1m3 = 1000L, lukt het dan?
Dat is ook goed! Nu weet je hoeveel mol H3O+ er in die bacterie zit.Nu dacht ik aan de mol berekenen door Concentratie maal volume te doen
Als laatste moet je nog enkel berekenen aan hoeveel moleculen (of ionen) dat gelijk is. Weet je via welke bekende constante je mol kan omzetten naar aantal moleculen?
"Success is the ability to go from one failure to another with no loss of enthusiasm" - Winston Churchill