ionisatie bij fysiologische pH (histamine)
Moderator: ArcherBarry
-
- Berichten: 20
ionisatie bij fysiologische pH (histamine)
Allereerst sorry indien dit niet bij de juiste groep staat, ik wist niet echt waar ik dit moest plaatsen.
Ik zie absoluut niet in wanneer een molecule geïoniseerd is bij een fysiologisch ph.
Zoals bij histamine bijvoorbeeld.
Histamine heeft twee centra, namelijk de alifatische aminogroep en welke stikstofatoom van de imidazoolring nog geen een proton. Onder fysiologische omstandigheden, zal de alifatische aminogroep (met een pKa rond 9.4) worden geprotoneerd, terwijl het tweede stikstof van de imidazol ring (pKa ≈ 5.8) zullen niet worden geprotoneerd.
hoe weet je dat??
Meestal teken ik een grafiekje en zie ik dat wanneer ik te maken heb met een vb base dat indien de pka groter is dan de ph dat er ioniastie zal zijn. en dit ook zo voor een zuur.
Helaas kan ik wel meestal niet afleiden aan de structuur of het om een base gaat. Zoals bij bijvoorbeeld fynetoïne. Als ik die figuur alleen nog maar zie weet ik niet hoe ik moet redeneren of dat deze structuur geioniseerd zal zijn bij fysiologische ph (ook niet wanneer er zelf gegeven wordt dat de pka gelijk is aan 8.3).
hopelijk verstaat iemand mijn vraag en kan ik mijn probleem eindelijk begrijpen!
Alvast bedankt
Ik zie absoluut niet in wanneer een molecule geïoniseerd is bij een fysiologisch ph.
Zoals bij histamine bijvoorbeeld.
Histamine heeft twee centra, namelijk de alifatische aminogroep en welke stikstofatoom van de imidazoolring nog geen een proton. Onder fysiologische omstandigheden, zal de alifatische aminogroep (met een pKa rond 9.4) worden geprotoneerd, terwijl het tweede stikstof van de imidazol ring (pKa ≈ 5.8) zullen niet worden geprotoneerd.
hoe weet je dat??
Meestal teken ik een grafiekje en zie ik dat wanneer ik te maken heb met een vb base dat indien de pka groter is dan de ph dat er ioniastie zal zijn. en dit ook zo voor een zuur.
Helaas kan ik wel meestal niet afleiden aan de structuur of het om een base gaat. Zoals bij bijvoorbeeld fynetoïne. Als ik die figuur alleen nog maar zie weet ik niet hoe ik moet redeneren of dat deze structuur geioniseerd zal zijn bij fysiologische ph (ook niet wanneer er zelf gegeven wordt dat de pka gelijk is aan 8.3).
hopelijk verstaat iemand mijn vraag en kan ik mijn probleem eindelijk begrijpen!
Alvast bedankt
- Pluimdrager
- Berichten: 2.722
Re: ionisatie bij fysiologische pH (histamine)
Histamine wordt als het twee H+opneemt een twee basisch zuur met pKa1= 5,8 en pka2=9,4.
Stel nu dat het in plaats van om histamine om een eenvoudig twee basisch zuur zou gaan als bv. H2S met Ka1 = 3,0 x 10-7 met als evenwichtsvergelijking voor de eerste ionisatietrap:
H2S
Lukt het dan wel om hiervoor de evenwichtsvoorwaarde op te stellen en de verhouding HS-/ H2S uit te rekenen bij bv. pH=7,0 ?
Stel nu dat het in plaats van om histamine om een eenvoudig twee basisch zuur zou gaan als bv. H2S met Ka1 = 3,0 x 10-7 met als evenwichtsvergelijking voor de eerste ionisatietrap:
H2S
\( \rightleftarrows \)
H+ + HS-Lukt het dan wel om hiervoor de evenwichtsvoorwaarde op te stellen en de verhouding HS-/ H2S uit te rekenen bij bv. pH=7,0 ?
-
- Berichten: 20
Re: ionisatie bij fysiologische pH (histamine)
Via de henderson Hasselbach zou ik het volgende doen:Margriet schreef: ↑zo 05 jan 2014, 21:54
Histamine wordt als het twee H+opneemt een twee basisch zuur met pKa1= 5,8 en pka2=9,4.
Stel nu dat het in plaats van om histamine om een eenvoudig twee basisch zuur zou gaan als bv. H2S met Ka1 = 3,0 x 10-7 met als evenwichtsvergelijking voor de eerste ionisatietrap:
H2S\( \rightleftarrows \)H+ + HS-
Lukt het dan wel om hiervoor de evenwichtsvoorwaarde op te stellen en de verhouding HS-/ H2S uit te rekenen bij bv. pH=7,0 ?
7 = (- log 3 *10 ^-7 ) + log [HS-/H2S]
Dus als resultaat zou ik zeggen dat de verhouding [HS-/H2S] 3 bedraagt?
Klopt het dat ik het volgende dan zou doen:
ik weet dat mijn verhouding gelijk is aan 3 en wil weten hoeveel er geioniseerd zal zijn dus stel ik
I/ I + NI = x
uit de formule van Hasselbach weet ik dat [HS-/H2S] = 3 dus I/NI = 3
<-> I = 3 NI
Dan stop ik dit allemaal in I/ I + NI = x en kom ik als uitkomst van x 75 % procent uit?
- Pluimdrager
- Berichten: 2.722
Re: ionisatie bij fysiologische pH (histamine)
Er is ook een tweede ionisatie trap met Ka2 = 1,2 x 10-13
HS-
Wat is nu deze verhouding S2-/HS- bij pH = 7,0 ?
Daarna doen we hetzelfde bij histamine dat twee H+ heeft opgenomen als zuur.
HS-
\( \rightleftarrows \)
H+ + S2-Wat is nu deze verhouding S2-/HS- bij pH = 7,0 ?
Daarna doen we hetzelfde bij histamine dat twee H+ heeft opgenomen als zuur.
-
- Berichten: 20
Re: ionisatie bij fysiologische pH (histamine)
Hier zou ik hetzelfde doen.
7 = - log ( 1,2 x 10-13 ) + log [S2-/HS-]
1,2 x 10-6= [S2-/HS-]
hier kan de vergelijking: ph = pka + log (acc/donor) gelijk gesteld worden aan ph = pka + log ( I/NI) (hoewel het is hier beiden geioniseerd?)
dus zou ik zeggen dat het 1.2 * 10 4 %geioniseerd is?
7 = - log ( 1,2 x 10-13 ) + log [S2-/HS-]
1,2 x 10-6= [S2-/HS-]
hier kan de vergelijking: ph = pka + log (acc/donor) gelijk gesteld worden aan ph = pka + log ( I/NI) (hoewel het is hier beiden geioniseerd?)
dus zou ik zeggen dat het 1.2 * 10 4 %geioniseerd is?
- Pluimdrager
- Berichten: 2.722
Re: ionisatie bij fysiologische pH (histamine)
Ok, de verhouding bij pH=7 is dus [H2S] : [HS-] : [S2- ] = 1 : 3 : 3,6 x10-6 en je kunt dus stellen dat bij pH=7 [S2-] verwaarloosbaar klein is.
Voor histamine kun je hetzelfde doen.
Neem voor histamine B, voor eenmaal geprotoneer HB+ en voor twee maal geprotoneerd H2B2+
Bereken nu voor H2B2+
Voor histamine kun je hetzelfde doen.
Neem voor histamine B, voor eenmaal geprotoneer HB+ en voor twee maal geprotoneerd H2B2+
Bereken nu voor H2B2+
\( \rightleftarrows \)
H+ + HB+ de verhouding [HB+ ]/ [H2B2+ ]bij de gewenst pH als pKa1 = 5,8.-
- Berichten: 20
Re: ionisatie bij fysiologische pH (histamine)
Hoe komt u aan die 3,6 x10-6 ?
7.4 = 5.8 + log [HZ+ ]/ [H2Z2+]
1.6 = log [HZ+ ]/ [H2Z2+]
39.81 = [HZ+ ]/ [H2Z2+]
7.4 = 5.8 + log [HZ+ ]/ [H2Z2+]
1.6 = log [HZ+ ]/ [H2Z2+]
39.81 = [HZ+ ]/ [H2Z2+]
- Pluimdrager
- Berichten: 2.722
Re: ionisatie bij fysiologische pH (histamine)
dat is 1,2 x10-4 % van 3.
Hoe komt u aan die 3,6 x10-6 ?
Dat is goed. Zeg maar dat de verhouding eenmaal/ tweemaal geprotoneerd = 40/1.
39.81 = [HZ+ ]/ [H2Z2+]
Nu voor de tweede trap met pKa2 = 9,4.
HZ+
\( \rightleftarrows \)
H++ Z.Wat is de verhouding [Z] / HZ+?
-
- Berichten: 20
Re: ionisatie bij fysiologische pH (histamine)
De verhouding van [Z] / HZ+ = 0.01
- Pluimdrager
- Berichten: 2.722
Re: ionisatie bij fysiologische pH (histamine)
Ok [Z] / HZ+= 0,01/1 = 0,40/40
en je kunt dus zeggen dat voor histamine bij pH=7,4
de verhouding tweemaal : eenmaal : niet geprotoneerd = 1 : 40 : 0,4
en je kunt dus zeggen dat voor histamine bij pH=7,4
de verhouding tweemaal : eenmaal : niet geprotoneerd = 1 : 40 : 0,4
-
- Berichten: 20
Re: ionisatie bij fysiologische pH (histamine)
Dit snap ik niet zo goed? Waarom doet u 0.01/1?
Dus uit de laatste zin kan ik concluderen dat histamine slechts 1 maal geprotoneerd zal zijn.
Die pka1 van 5.8 is afkomstig van de imidazool? En net daarbij kwamen we 40 uit dus zou ik denken dat die geprotoneerd zou moeten zijn bij fysiologische ph (maar het is de amine die geprotoneerd is?).
Dus uit de laatste zin kan ik concluderen dat histamine slechts 1 maal geprotoneerd zal zijn.
Die pka1 van 5.8 is afkomstig van de imidazool? En net daarbij kwamen we 40 uit dus zou ik denken dat die geprotoneerd zou moeten zijn bij fysiologische ph (maar het is de amine die geprotoneerd is?).
- Pluimdrager
- Berichten: 2.722
Re: ionisatie bij fysiologische pH (histamine)
Misschien is het, bij nader inzien, beter/duidelijker om de echte formules te gebruiken.
De berekeningen blijven uiteraard hetzelfde.
De imidazolgroep Im wordt geprotoneerd er ontstaat ImH+ met pKa=5,8.
Je krijgt dan bij pH = 7,4:
7,4 = 5,8 + log [Im]/ImH+] en
[Im]/ImH+] = 40/1
Er is dus bij pH=7,4 40 x meer Imidazole niet, dan wél geprotoneerd.
Idem voor de aminegroep RNH2 . Geprotoneerd ontstaat RNH3+ met pKa=9,4.
En bij pH=7 geldt:
7,4 = 9,4 + log [RNH2] / [RNH3+ ] en
[RNH2] / [RNH3+ ]= 1/100
En er is dus bij pH=7,4 100x meer amine wél, dan niet geprotoneerd.
Tot zover eens?
De berekeningen blijven uiteraard hetzelfde.
De imidazolgroep Im wordt geprotoneerd er ontstaat ImH+ met pKa=5,8.
Je krijgt dan bij pH = 7,4:
7,4 = 5,8 + log [Im]/ImH+] en
[Im]/ImH+] = 40/1
Er is dus bij pH=7,4 40 x meer Imidazole niet, dan wél geprotoneerd.
Idem voor de aminegroep RNH2 . Geprotoneerd ontstaat RNH3+ met pKa=9,4.
En bij pH=7 geldt:
7,4 = 9,4 + log [RNH2] / [RNH3+ ] en
[RNH2] / [RNH3+ ]= 1/100
En er is dus bij pH=7,4 100x meer amine wél, dan niet geprotoneerd.
Tot zover eens?
-
- Berichten: 20
Re: ionisatie bij fysiologische pH (histamine)
Ajaaa!!! nu enorm duidelijk, dank u 
Dus stel dat ik het nu toepas bij fenytoïne.
Ik heb gezien als regel dat je je volgende formules opstelt:
ph = pka + log (acc/donor)
dan moet ik kijken of de acceptor hetzij de donor geprotoneerd. Zo weet ik of ik of
ph = pka + log (I/NI) of ph = pka + log (NI/I) moet gebruiken.
Maar als ik fenytoïne bekijk
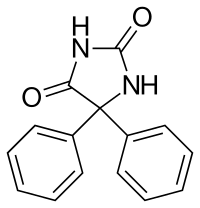
Weet ik niet of er een H af of bij zou komen.. dus kan ik niet echt bepalen wat de donor of acceptor is in dit geval.
Snapt u wat ik bedoel?
(alleszins al enorm bedankt, al een enorme hulp geweest!)
Dus stel dat ik het nu toepas bij fenytoïne.
Ik heb gezien als regel dat je je volgende formules opstelt:
ph = pka + log (acc/donor)
dan moet ik kijken of de acceptor hetzij de donor geprotoneerd. Zo weet ik of ik of
ph = pka + log (I/NI) of ph = pka + log (NI/I) moet gebruiken.
Maar als ik fenytoïne bekijk

Weet ik niet of er een H af of bij zou komen.. dus kan ik niet echt bepalen wat de donor of acceptor is in dit geval.
Snapt u wat ik bedoel?
(alleszins al enorm bedankt, al een enorme hulp geweest!)
- Pluimdrager
- Berichten: 2.722
Re: ionisatie bij fysiologische pH (histamine)
Het is natuurlijk bekend dat carbonzuren protondonors zijn en aminen protonacceptors. Maar fenytoïne is een lastige. Het is ook bekend dat Succinimide en phthalimide met een wat overeenkomstige structuur zwakke zuren zijn dus ik verwacht dat fenytoïne dat ook zal zijn en dus een H+ kan afstaan.
Bovendien vond ik op dit forum dit:
http://www.wetenscha...urbase-reactie/
Je zult dus om te weten of een stof een H+kan afstaan of opnemen soms op onderzoek moeten uitgaan.
Bovendien vond ik op dit forum dit:
http://www.wetenscha...urbase-reactie/
Je zult dus om te weten of een stof een H+kan afstaan of opnemen soms op onderzoek moeten uitgaan.
-
- Berichten: 20
Re: ionisatie bij fysiologische pH (histamine)
oke, bedankt.
Mag ik een ander voorbeeldje vragen opdat ik het zeker zou snappen?
Bijvoorbeeld Timolol
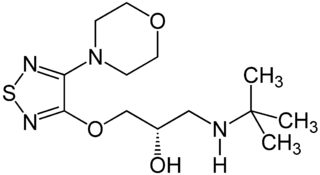
Klopt het dat het hier als protonacceptor staat? En dat de donor er zou uitzien met een proton meer aan de meest rechtse N ?
Als ik hier dan de ionisatie moet berekenen bij fyisiologische ph met een pka van 8.8 zou ik dit als volgt doen:
ph = pka + log (acc/ donor) ==> ph = pka + log (NI/I)
7.4 = 8.8 + log (NI/I)
0.0398 = (NI/ I ) <--> NI = 0.0398 I
aangezien : I / (I+NI) <--> 1/(1.0398) * 100 = 96 %
Bij fysiologische ph is dus 96 % procent dus kan ik zeggen dat het in de geladen vorm (meer bepaald aan die meest rechste N ) zal voorkomen?
Mag ik een ander voorbeeldje vragen opdat ik het zeker zou snappen?
Bijvoorbeeld Timolol

Klopt het dat het hier als protonacceptor staat? En dat de donor er zou uitzien met een proton meer aan de meest rechtse N ?
Als ik hier dan de ionisatie moet berekenen bij fyisiologische ph met een pka van 8.8 zou ik dit als volgt doen:
ph = pka + log (acc/ donor) ==> ph = pka + log (NI/I)
7.4 = 8.8 + log (NI/I)
0.0398 = (NI/ I ) <--> NI = 0.0398 I
aangezien : I / (I+NI) <--> 1/(1.0398) * 100 = 96 %
Bij fysiologische ph is dus 96 % procent dus kan ik zeggen dat het in de geladen vorm (meer bepaald aan die meest rechste N ) zal voorkomen?