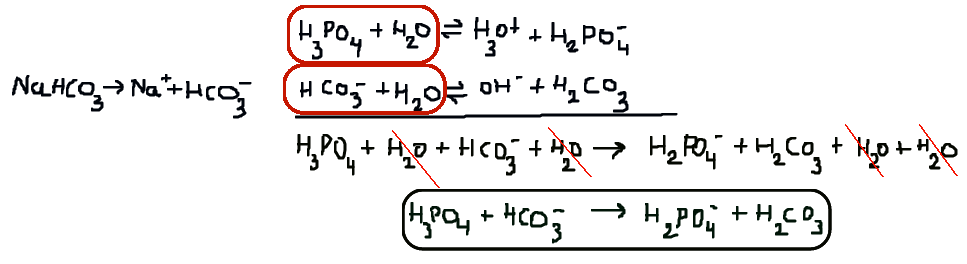Wdeb schreef: ↑do 30 jan 2014, 17:21
Dus dit lijkt te bewijzen dat ook bij een zwak zuur de zuur-base-reactie eigenlijk gaat tussen het OH
- en de H3O
+. En gezien de evenwichtsbeïnvloeding is het ook wel logisch..
Of het bewijst is dat de oplosbaarheid van CaCO
3 in ijsazijn anders is dan in een verdunde oplossing daarvan in water. Hoe het mechanisme precies is, wat de snelheidsbepalende stap is en wat er nu precies voor zorgt dat de snelheid anders is valt aan de hand van een dergelijke waarneming niet te concluderen.
En sowieso maakt dit alles niet uit voor de schrijfwijze van de totaalreactie. Men moet kinetiek niet verwarren met thermodynamica.
Hoe zwakke zuren en zwakke basen precies met elkaar reageren is ook helemaal niet belangrijk. Wat belangrijk is, of deze reageren. Die vraag wordt beantwoord door te kijken in de tabel met zuren en basen. Als het geconjugeerde zuur en de geconjugeerde base die bij de reactie zouden ontstaan zwakker zijn dan het zuur en de base waarmee men begon, verloopt de reactie. Anders niet. Een heel simpele stelregel waarmee men voor alle zuren en basen kan bepalen wat er gebeurt:
Bij mengen van:
Een
sterk zuur en
sterke base: aflopende reactie
Een
sterk zuur en
zwakke base: aflopende reactie
Een
zwak zuur en
sterke base: aflopende reactie
Een
zwak zuur en
zwakke base: Evenwicht*
In het laatste geval kan het evenwicht
rechts liggen (de reactie verloopt voor een groot deel) of
links (de reactie verloopt nauwelijks). Zoals aangegeven: Als het geconjugeerde zuur en de geconjugeerde base die ontstaan zwakker zijn dan het zuur en de base waarmee men begon, ligt het evenwicht rechts. Anders ligt het evenwicht links (de reactie verloopt nauwelijks, in de chemie spreekt men dan doorgaans van "niet")
Een paar simpele stelregels, waarmee alle vragen zijn te kraken. Gedoe over waardes van evenwichtsconstantes bij sterke zuren,plaatjes over hoe zuur-basereacties verlopen zijn overbodig. Het klinkt cru, maar iedere poging om meer inzicht te verschaffen achter deze simpele stelregels doet in veel gevallen meer kwaad dan goed. Omdat ze gebaseerd zijn op een onjuiste voorstelling van zaken (en leidt dus tot een verkeerd begrip van de onderliggende materie) of ook nog eens een hoop extra vragen oproepen die alleen maar afleiden van waar het echt om gaat: begrijpen wat een zuur is, en wat een base. En begrijpen dat een zuur met een base reageert.
Om terug te komen op de term neutralisatiereactie: wanneer een zuur reageert met een base, zal pH van de reactie meer in de buurt komen te liggen van die van zuiver water. De pH gaat dus
in de richting van pH-neutraal, en daarom spreekt men in dergelijke gevallen vaak (ook) van neutralisatie, ook al is de eindtoestand niet geheel neutraal.
De term neutralisatiereactie is dus niet voorbehouden aan een reactie tussen een sterk zuur en een sterke base, en dus ook niet voorbehouden aan de reactie:
H
3O
+ + OH
- 2 H
2O