Ik heb op wikipedia deze zuur basereactie gevonden en ik wou het zelf even oplossen om te zien of ik de materie onder de knie heb, maar ik kom niet tot dezelfde reactieproducten! Kan iemand me aub helpen?
Ik heb gemerkt dat als ik het gewenste resultaat wil bekomen ik 2 HCl moleculen moet nemen zodat er 2H3O+ moleculen ontstaan die 2 H+ opnemen van 1 CO32- molecuul! Maar waarom neemt CO32- twee protonen op en niet 1 zoals in mijn oplossing? Dit is mijn hoofdprobleem: Ik weet dus niet hoe ik kan weten of er 1 of 2 H+ worden opgenomen. CO32- is een base en zou zoals normaal 1 H+ moeten opnemen, als er 2 worden opgenomen dan spreken we al van een andere base(!) namelijk HCO32- die dat verderopneemt en daar gaat deze oefening niet om!
Hartelijk bedankt!
reactie producten wikipedia:
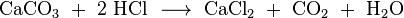
reactieproducten zelf verkregen:

