Even voor de goede orde, want de zeer belangrijke opmerking die Wdeb maakt dreigt een beetje ondergesneeuwd te raken:
Hybridisatie wordt gebruikt om blijkbaar gelijkwaardige bindingen te kunnen verklaren, terwijl dat niet logisch volgt uit het schillenmodel
Met hybridisatie kun je verklaren waarom koolstof 4 bindingen aangaat, terwijl C in de grondtoestand maar 2 ongepaarde elektronen heeft. Je kunt er ook mee verklaren waarom de bindingshoeken in NH
3 en H
2O zijn zoals ze zijn. Hybridisatie is dus een model om zaken te verklaren. Het is echter geen must, want sommige zaken kun je prima verklaren zonder dit model.
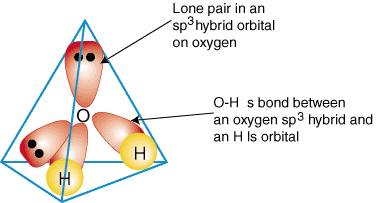
En zoals alle modellen, is het model van hybridisatie geen complete beschrijving. Op basis van hybridisatie zou je bijvoorbeeld verwachten dat de lading van de 2 vrije elektronenparen in het H
2O verdeeld zou zijn over 2 lobben, en dat is in werkelijkheid pertinent niet het geval (er wordt wel gezegd:
het watermolecuul heeft geen "konijnenoren"). Hybridisatie is dus ook geen algemeen geldende waarheid.
Met andere woorden, als iemand de structuur van Cl-Cl correct kan beschrijven zonder gebruik te maken van hybridisatie, dan is daar niets mis mee. Mcfaker maakt een opmerking over bindingshoeken, maar een molecuul bestaande uit 2 atomen heeft per definitie geen bindingshoek, dus dat aspect is sowieso niet van belang.
Conclusie: Wat in het boek staat is juist. Het zogenaamde tegenbewijs dat je "op internet" vond is niet relevant.
Betekent dat dat je ongelijk hebt? Ook niet. Als je aanneemt dat hybridisatie optreedt, er 4 sp
3-orbitalen worden gevormd, waarvan er 3 worden gevuld met 2 elektronen en het andere deel gaat nemen in een covalente binding kom je ook aan een juiste structuur voor Cl-Cl. In dit geval kan dus allebei!
Tenslotte: Het plaatje wat je in het eerste bericht laat zien, toont enkel de binding die in Cl-Cl aanwezig is. De andere orbitalen worden niet getoond, maar zijn er wel degelijk; alleen is het zo dat die orbitalen exclusief op 1 atoom zitten en gevuld zijn met 2 elektroen - vrije elektronenparen dus! Inderdaad rolt daar volgens deze beschrijving uit dat die een hoek van 90 graden maken met elkaar - maar vraag je eens af: wat voor redenen heb je om aan te nemen dat dat niet klopt?