Zoals je het hier stelt:
Daarin wordt vertrokken van Qop+Qaf=0 en daarna wordt er nagegaan wat warmte opneemt en wat afgeeft. Als je bijvoorbeeld een blok heet tin in een calorimeter met lauw water doet, vind ik het makkelijker om die twee dingen apart te bepalen. Qop wordt dan in dit voorbeeld de Q van de calorimeter + de Q van het water, terwijl Qaf de smeltwarmte van het tin is + de Q van het vloeibaar geworden tin + de Q van het vaste tin. Begin- en eindtemperatuur zijn bekend, dus hoef je de dingen gewoon in te vullen.
vraag ik me af waar je vastloopt.
Ik weet niet of je het ziet, maar
Qop wordt dan in dit voorbeeld de Q van de calorimeter + de Q van het water
dat zijn twee regels in mij tabel
Qaf de smeltwarmte van het tin is + de Q van het vloeibaar geworden tin + de Q van het vaste tin.
dat zijn drie regels in mijn tabel
Begin- en eindtemperatuur zijn bekend, dus hoef je de dingen gewoon in te vullen
en dat is exact wat ik doe in die tabel.
Dus waar loop je dan eigenlijk vast? Want je lóópt vast als ik je goed begrijp.

Hierboven je gegevens ingevuld in de tabel. Mij boeit het niet te weten of ik iets bij Qop of Qaf moet zetten, dat rolt vanzelf uit mijn formule Q=m·c·ΔT, een positieve ΔT geeft vanzelf een positieve Q (de stof neemt energie op) en negatieve ΔT geeft vanzelf een negatieve Q.
En dan denk ik dat je vastloopt op het feit dat je de eindtemperatuur niet kent, en dus geen enkele Q kunt berekenen. Dus wat doe ik, ik ga eens kijken wat er gebeurt als ik alles naar één toestand breng, 0°C . Op de eerste regel krijg ik dan voor mijn water een ΔT van - 25 K, en dus een Q van 0,2 x 4190 x -25 = -20 950 J
tweede regel: 0,1 x 840 x -25 = - 2100 J
derde regel: 0,015 x 2090 x +15 = + 470,25 J
vierde regel: 0,015 x 333 000 = + 4995 J
vijfde regel: 0,015 x 4190 x 0 = + J
Ik heb nu een bakje met 215 g water van 0°C, en het energieresultaat is -20 950 -2100 + 470,25 +4995 = - 17584,75 J, ofwel netto heeft het systeem ruim 17 kJ afgestaan.
Ik heb dus 17 584,75 J tot mijn beschikking om 215 g water en 100 g glas op te warmen vanaf 0°C. Die vul ik positeif in in de Q-kolom op de laatste regel. (Als ik nu alle Q's in de Q-kolom optel kom ik netjes op nul uit). De massa van mijn combinatie water plus glas is simpel, 0,215 + 0,100 = 0,315 kg.
OM van die combinatie een warmtecapaciteit te bepalen heb ik een gewogen gemiddelde nodig:
\(\frac{(0,215 \times 4190) + (0,100 \times 840)}{0,215 + 0,100}= 3126,51 J/kg\cdot K\)
die vul ik in op de plaats van de x in de tabel, als de soortelijke warmte van mijn water/glas "mengsel".
De begintemperatuur van waaraf ik die + 17 584,75 J begin toe te voeren is 0°C, die kan ook in de tabel, en als ik dan op die regel uitvoer ΔT=Q/m·c, dan vind ik een ΔT van +17,9 K. Ik begon bij 0°C, eindtemperatuur wordt dan +17,9°C.
En hoe je het ook wendt of keert, simpeler kan dit echt niet. Die tabel gebruik ik alleen maar om overzicht te houden over wat ik aan het doen ben, zodat ik regel voor regel en kolom voor kolom kan zien welke gegevens ik stap voor stap kan aanvullen.
 (afb. #)
(afb. #)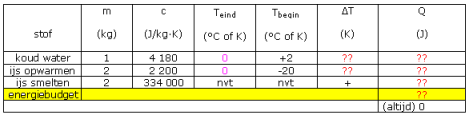 (afb. #)
(afb. #) (afb. #)
(afb. #) (afb. #)
(afb. #)