U is toch de inwendige energie? is dit niet gelijk aan de kinetische energie plus de potentiele energie?
Als p stijgt gaat dan een van deze niet ook stijgen?
De inwendige energie bestaat uit de Ekin, de Epot en de intramoleculaire van de moleculen zelf...
Oftewel:
Het is energie in de vorm van:
a. Kinetische energie van de moleculen
b. Potentiele energie van de moleculen, die zijn oorzaak vindt in de onderlinge aantrekkingskracht van de moleculen.
c. Intramoleculaire energie. Dit is energie die in de moleculen zelf zit.
Wanneer je het over een ideaal gas hebt, vallen b en c weg en hou je dus de kinetische energie van de moleculen over.
Dat betekent dan dus ook wanneer je een ideaal gas isochoor verwarmt, de kinetische energie van de moleculen toeneemt en daarmee ook de inwendige energie.
Volgens de eerste wet van de thermodynamica geldt nu, dat de hoeveelheid toegevoerde warmte gelijk is, aan de toename van de inwendige energie + de geleverde arbeid !!.
Ik bedoelde hiermee mijn voorbeeld, en in mijn voorbeeld wordt er naar mijn mening geen arbeid geleverd oftewel, hier zou volgens de eerste wet van de thermodynamica gelden dat de hoeveelheid toegevoerde warmte gelijk is aan de toename van de inwendige energie.
Maar volgens de formule van Boyle - Gay Lussac:
(p V) / T = n R T
Zal ook de druk toenemen, omdat de temperatuur toeneemt en het volume constant is, duidelijk...
Omdat het volume constant blijft wil dit zeggen dat er GEEN arbeid W geleverd word, enkel de inwendige energie van het systeem gaat veranderen (ΔU)
Klopt, maar de druk gaat toch echter ook toenemen? En daarmee lijkt mij dat het volume-energie dus ook toeneemt...
Wanneer je in een gesloten systeem zit met een veranderlijke samenstelling dan krijg je de eerste hoofdwet in diffrentiaalvorm:
zie wikipedia
Wat wordt er precies onder een veranderlijke samenstelling gezien?
De wet van de thermodynamica is volgens mij wel goed toepasbaar op het volgende voorbeeld:
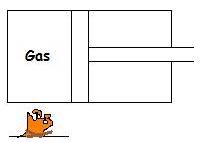
Stel dat dit proces isotherm gebeurd.
Volgens de eerste wet van de thermodynamica is Q = ΔU + W, maar omdat T2 - T1 hier gelijk aan 0 is volgt er:
Q = W, oftewel alle toegevoerde warmte wordt hier in arbeid omgezet. Dit lijkt me volledig te kloppen, want het volume energie veranderd in dit geval niet omdat de temperatuur niet veranderd...
Alleen in mijn eerste voorbeeld is dat wel het geval, dus lijkt me dat je daar de volume energie nog bij op moet tellen...