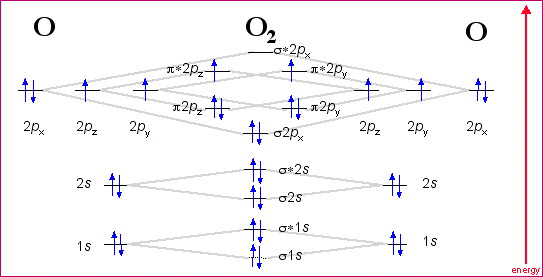
Ik heb een vraag ivm het molecuulorbitaal-diagram van O2.
Ik snap niet waarom je voor de p-orbitalen een zowel sigma als pi - MO'en krijgt. Voor de s-orbitalen lijkt het me volkomen logisch dat je dan sigma2s en sigma*2s krijgt, maar bij de 2p-orbitalen ga ik volledig de mist in. Kan iemand me dit traag en voorzichtig uitleggen? Ik ben nog niet echt vertrouwd met de MO-theorie, want ik leerde dit maar bij sinds vanmorgen
groetjes,
abel.