Kun je de (verandering van) inwendige energie definiëren als de (verandering van) kinetische energie op atomair/moleculair niveau? Zodat ΔU = 3/2nRΔT?
Maar hyperphysics spreekt dit tegen: (vertaald: "Hun inwendige energie ... zullen niet noodzakelijk gelijk zijn")
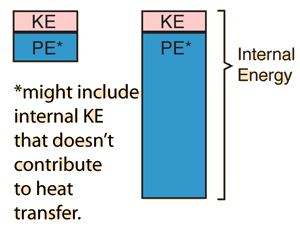
(bron: http://hyperphysics.phy-astr.gsu.edu/hbase.../temper.html#c1 )
Ben ik juist in denken dat dat is omdat zij het hebben over de totale inwendige energie en ik over de verandering ervan? Zij spreken dus over 2 verschillende gassen (met andere intrinsieke eigenschappen die een andere inwendige energie geven) die dan op een gelijke temperatuur tot een zelfde nieuwe temperatuur worden verhoogd, zodat de verandering wel hetzelfde is, maar het totaal verschillend... (waarom ik dus in de eerste zin hebben gezet "twee (identieke) gassen")
P.S.: (just for fun) wie kan de meest volledige definitie van inwendige energie geven?