Dipoolmoment
Moderator: ArcherBarry
Forumregels
(Middelbare) school-achtige vragen naar het forum "Huiswerk en Practica" a.u.b.
Zie eerst de Huiswerkbijsluiter
(Middelbare) school-achtige vragen naar het forum "Huiswerk en Practica" a.u.b.
Zie eerst de Huiswerkbijsluiter
-
- Berichten: 24
Dipoolmoment
hey,
Ik snap een bepaalde vraag niet van scheikunde dipoolmomenten.
Het boek vraag: bepaal voor elke verbinding het omringingsgetal van het centrale atoom.
CO2, COCl2, BF3 en PCl3
Maar bij de eerste: CO2 staat dat ie een lineaire 2-omringing heeft. Dit klopt toch niet, want omdat de covalentie van C = 4 en de valentie = 4, krijg je toch een tetraëdrische vorm???
Enig idee?
groetjes Laserjet
Ik snap een bepaalde vraag niet van scheikunde dipoolmomenten.
Het boek vraag: bepaal voor elke verbinding het omringingsgetal van het centrale atoom.
CO2, COCl2, BF3 en PCl3
Maar bij de eerste: CO2 staat dat ie een lineaire 2-omringing heeft. Dit klopt toch niet, want omdat de covalentie van C = 4 en de valentie = 4, krijg je toch een tetraëdrische vorm???
Enig idee?
groetjes Laserjet
- Berichten: 3.112
Re: Dipoolmoment
De beide O-atomen zijn dubbel gebonden aan het C-atoom.LaserJet schreef:Ik snap een bepaalde vraag niet van scheikunde dipoolmomenten. Het boek vraag: bepaal voor elke verbinding het omringingsgetal van het centrale atoom.
Maar bij CO2 staat dat ie een lineaire 2-omringing heeft.
Overigens, lettend op de titel, vanwege de symmetrie van het molecule is het elektrische dipoolmoment nul.
-
- Berichten: 817
Re: Dipoolmoment
Probeer het zo te zien.
De reden waarom de bindingen met een koolstofstofatoom (met 4 bindingen) tetraëdrish georiënteerd zijn, is omdat dan de onderlinge hoek tussen alle bindingen even groot is (+- 109.5°).
Die electronenwolken zijn allemaal negatief geladen, en willen liefst zo ver mogelijk van elkaar af zitten.
Als je maar 2 bindingen hebt (wel bestaande uit 2 delen. De sigma- en pi -electronen), gaan deze ook zo ver mogelijk van elkaar willen zitten.
Je mag elke mogelijke structuur bedenken, maar aangezien een cirkel 360° heeft, is de maximale hoek die je tussen 2 bindingsrichtingen kan krijgen 180°
Deze hoek proberen de bindingen dan ook aan te nemen (zo ver mogelijk van elkaar).
Als je vanuit een centraal atoom 2 bindingen tekent, met 180° ertussen, zit je in een rechte lijn.
CO2 heeft dus een lineaire vorm. Geen tetraëdrische.
Dit is misschien wat simpel voorgesteld, maar het helpt mij om het te visualiseren en te bepalen hoe het molecule er ruimtelijk uit ziet.
Hopelijk verduidelijkt dit het wat voor je
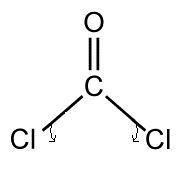
ruwweg zelfde verhaal bij COCl2
Een dubbel gebonden zuurstof, en 2 enkel gebonden Cl.
Bij 3 bindingsrichtingen kan je nog steeds in 1 vlak werken.
de maximale hoek is dan 120°, en dat probeert het molecule te bereiken.
Als je iets dieper ingaat op de structuur zie je wel dat het hier niet netjes 120° is.
Bij de dubbele binding heb je sigma- EN pi- electronen. Door de grotere hoeveelheid aan negatieve lading, zullen de andere 2 bindingen (bestaande uit alleen sigma bindingen) wat naar elkaar toe geschoven worden.
De reden waarom de bindingen met een koolstofstofatoom (met 4 bindingen) tetraëdrish georiënteerd zijn, is omdat dan de onderlinge hoek tussen alle bindingen even groot is (+- 109.5°).
Die electronenwolken zijn allemaal negatief geladen, en willen liefst zo ver mogelijk van elkaar af zitten.
Als je maar 2 bindingen hebt (wel bestaande uit 2 delen. De sigma- en pi -electronen), gaan deze ook zo ver mogelijk van elkaar willen zitten.
Je mag elke mogelijke structuur bedenken, maar aangezien een cirkel 360° heeft, is de maximale hoek die je tussen 2 bindingsrichtingen kan krijgen 180°
Deze hoek proberen de bindingen dan ook aan te nemen (zo ver mogelijk van elkaar).
Als je vanuit een centraal atoom 2 bindingen tekent, met 180° ertussen, zit je in een rechte lijn.
CO2 heeft dus een lineaire vorm. Geen tetraëdrische.
Dit is misschien wat simpel voorgesteld, maar het helpt mij om het te visualiseren en te bepalen hoe het molecule er ruimtelijk uit ziet.
Hopelijk verduidelijkt dit het wat voor je
ruwweg zelfde verhaal bij COCl2
Een dubbel gebonden zuurstof, en 2 enkel gebonden Cl.
Bij 3 bindingsrichtingen kan je nog steeds in 1 vlak werken.
de maximale hoek is dan 120°, en dat probeert het molecule te bereiken.
Als je iets dieper ingaat op de structuur zie je wel dat het hier niet netjes 120° is.
Bij de dubbele binding heb je sigma- EN pi- electronen. Door de grotere hoeveelheid aan negatieve lading, zullen de andere 2 bindingen (bestaande uit alleen sigma bindingen) wat naar elkaar toe geschoven worden.

"Beep...beep...beep...beep"
~Sputnik I
~Sputnik I