Ik heb nog een vraag, aanvullend terwijl ik dit aan het bekijken ben.
Het gaat nu over de omzetting van:
Alcohol -> Aldehyde -> Carbonzuur
In mijn voorbeeld:
Ethanol -> Ethanal -> Ethaanzuur
Ik heb dit op papier uitgetekend:
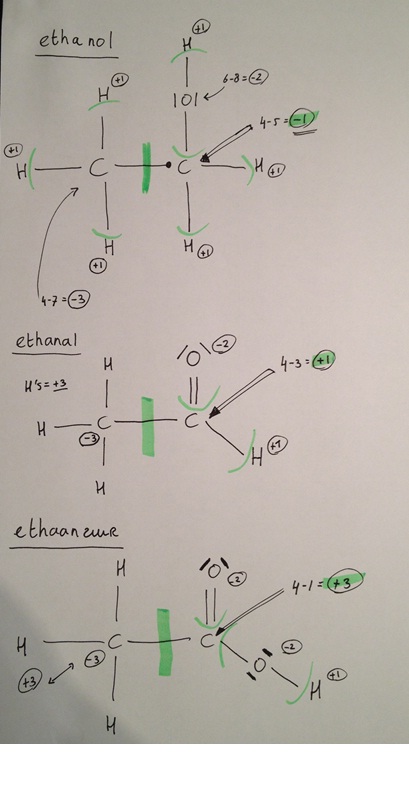
Wat ik hier dus zie, als ik het goed begrijp:
In de CH3 groep, blijft de lading in principe altijd onveranderd,
logisch aangezien hier niks aan veranderd.
In de alcohol:
C-atoom heeft een waarde van -1 (oxidatie-getal)
Aangezien de binding tussn de 2C's eerlijk verdeeld wordt.
Aldehyde:
C-atoom heeft een waarde van +1
(Het zuurstof atoom heeft een elektron paar meer, wat eerst aan een H toebehoorde,
en het C-atoom heeft daarom van 1 electron paar geen electronen meer)
Carbonzuur: C-atoom waarde: +3.
Ook hier zie je, dat het gehele molecule neutraal is. (som der oxidatie getallen is nul)
Maar is dit ook echt 'neutraal' ?
Bij de formele lading, is elk atoom (in bijv. de alcohol) neutraal (C heeft lading 4-4=0).
En de som van de FL = ook 0.
Wat kan je hier uit afleiden ?
Is dit normaal bij bijv. Na+ ook zo ?
Mag je tussen de twee C-atomen het e-paar zomaar 'doorhakken' om het oxidatiegetal te bepalen?
Mijn oude scheikunde leraar heeft ooit verteld, dat het aantal bindingen,
gelijk is aan het aantal stappen naar het edelgas rechts ervan.
Klopt dit altijd ? Bij bijv. C=4 , O=2 , N=3 enz. klopt het. Maar wat is de basis van deze regel?

