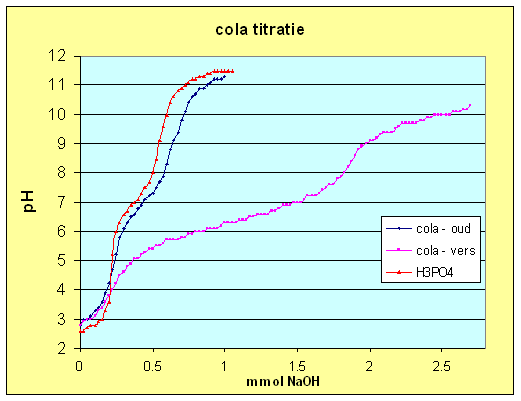
Ik begrijp dat het equivalentiepunt het punt is waar de titratiecurve op z'n steilst is. Maar is er ook een manier om, voordat je de titratie hebt afgerond, te berekenen waar het equivalentiepunt zit?
Ik heb overigens al wel het practicum gedaan, curve en alles heb ik, maar voor het verslag dat ik moet schrijven wou ik eigenlijk doen alsof ik zeer veel aan mijn voorbereiding heb gedaan.. (Als scholier schiet dat er nog wel eens doorheen
Alvast bedankt
Herman
P.S. Het kan misschien lijken dat ik veel vragen stel, maar dat is toch echt voornamelijk Rachel
EDIT: Nu lees ik ergens dat een equivalentiepunt ook een buigpunt kan zijn?! I've lost it..!
EDIT 2: Ik leest nu hier :
Voor een zwak zuur tijdens de titratie geldt:
pH = pKz + log zout/zuur
Uit deze formule blijkt dat pKz = pH halverwege het equivalentiepunt.
Als pKz = pH halverwege het equivalentiepunt, is 2x pKz dan de pH op het evp? Denk het niet maar ik vraag gewoon..