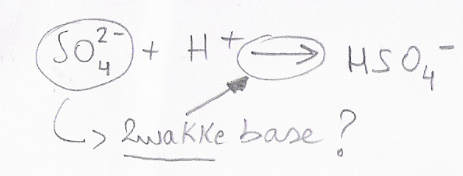
Waarom is sulfaat een zwakke base als er een aflopende pijl wordt aangegeven??
Een sterke base neemt toch gemakkelijk protonen op en de eenrichtingspijl geeft toch aan dat het een sterke base is!
SO
42- behoort tot de (zeer) zwakke basen. Dit betekent dat het deeltje een H
+kan opnemen. Dit proces is echter omkeerbaar. Het zwakke zuur HSO
4-kan ook weer een H
+afstaan.
SO
42- + H
+ 
HSO
4-
Het is een omkeerbare reactie waarbij beide reacties gelijktijdig verlopen. Dit wordt weergegeven met een dubbele pijl.
Maar dit betekent echter niet dat je de twee reacties niet afzonderlijk mag beschouwen en mag weergeven.
Je mag gerust spreken over de heengaande reactie en deze als volgt noteren:
SO
42- + H
+ → HSO
4-
En ook over de teruggaande reactie en deze ook alsvolgt noteren:
HSO
4- → H
+ + SO
42-
Dat is niet verkeerd. Een enkele pijl geeft alleen aan dat de deeltes voor de pijl omgezet worden in de deeltjes na de pijl en zegt niets over een eventuele omkeerbaarheid.
 HSO4-
HSO4-
