Bedankt voor de steun en uitleg.
Inmiddels heb ik ook het vak bio-inorganic chemistry (o.a. over metalen in biologische systemen)
en dat verklaart een hoop.
Zuurstof bind dus inderdaad covalent op ijzer als ligand ,evenals CO natuurlijk, wat daardoor verstikking te weeg kan brengen.
Volgens de volgende bron van Oxford:
http://www.chem.ox.ac.uk/vrchemistry/nonmetals/lecture5/ligand.html
lijkt het net alsof N2 dit ook kan in heme, wat natuurlijk niet zo is, toch is N maar 2 pm groter dan O (resp. 75 en 73 pm). Waarschijnlijk niet mogelijk door de slechte oplosbaarheid van N2 in water.
Quote Wiki:
"
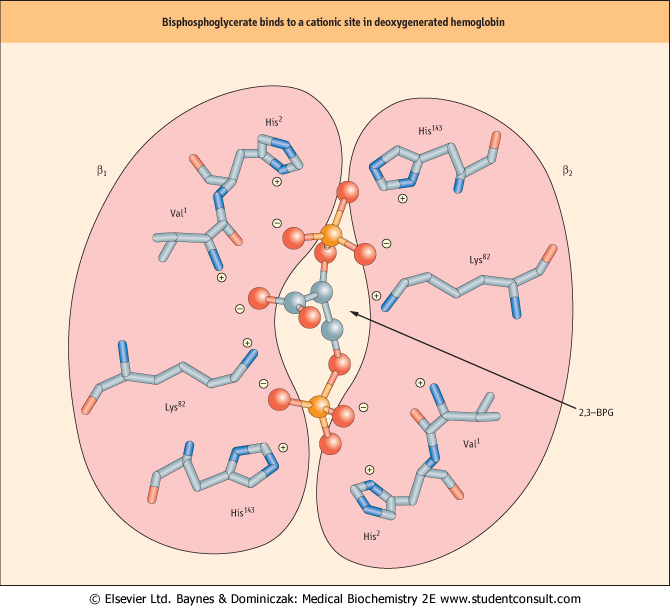
This allosteric effector binds to a site on the tetramer that is only present on the Tense(T) form of hemoglobin. The site is in the form of a pocket which is bordered by beta subunits. These positively charged subunits, His143, Lys82, and His2, interact with 2,3-BPG holding it in place. When the equilibrium of the tense form is pushed to the relaxed(R) form, the bonds that hold the 2,3-BPG molecule in place are broken and it is released. The hemoglobin stays in the T form during low concentrations of oxygen, so when 2,3-BPG is present, more of the oxygen binding sites must be filled in order for the transition from T to R form to occur."
http://en.wikibooks.org/wiki/Structural_Biochemistry/Protein_function/Heme_group/Hemoglobin#Binding_Sites_of_Hemoglobin
Dat snap ik bijna helemaal en verklaart een hoop, maar hellaas kan ik kan die "
His143, Lys82, and His2" niet vinden in het model.. Waarschijnlijk is het model dan ook de R-vorm (met zuurstof bindende voorkeur).. Dat is nog wel een wens van mij om die 2,3-BPG bindplaats te vinden..
Zo zou het binden in het centrum van hemoglobine:
http://aris.gusc.lv/ChemFiles/MedBiochem2edBaynes07/HTML/common/showimage.cfm@mediaisbn=0723433410&size=thumbnails&figfile=m33410-004-f007.jpg
Is CO2 hier gebonden aan 2,3-BPG molecuul of lijkt dat maar?
http://upload.wikimedia.org/wikibooks/en/thumb/d/d4/BPG.JPG/220px-BPG.JPG
Verder bindt CO2 dus in de vorm van koolzuur in de rode bloedcel (waardoor de zuurgraad omhoog gaat, de T-vorm gestabiliseerd wordt en de O2 affiniteit van hemoglobine afneemt, en O2 dus kan vrijkomen, in CO2 rijk weefsel).
Verder enig idee trouwens hoe een Heme groep in hemoglobine wordt ingebouwd? Is er een Fe2+ drager in je lichaam (anders dan heme)?
Volgende post ga ik schrijven over Telomerase modellen

Voorproefje:
Davidson College (c) 2010:
http://www.bio.davidson.edu/Courses/Molbio/MolStudents/spring2010/Jordan/telomerase_structure.html
Versus
University of Copenhagen researchers and an international team:
http://www.kurzweilai.net/mapping-the-fountain-of-youth
Wie was er eerst, wat is er extra ontdekt, werking van telomerase uitpluizen.