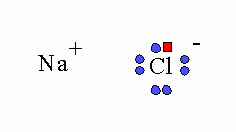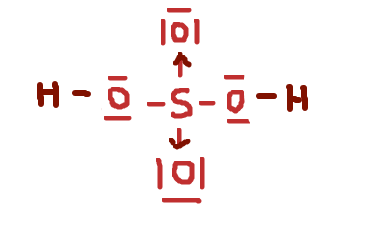mcfaker123 schreef: ↑vr 09 aug 2013, 23:00
Bedankt Marko, maar PCl5 , P bevat meer dan 8 electronen en het staat bij lewisstructuren in mijn nederlandse boek. Is dat dan ook geen lewisstructuur maar een structuurformule?
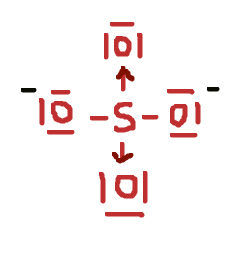
Dat zou inderdaad geen lewis-structuur zijn. Misschien wel even goed om een stap terug te nemen, hoop dat je er niet verder door in verwarring komt. Zoals Fuzzwood aangeeft, de theorie van Lewis werkt eigenlijk niet goed voor elementen uit de derde periode en verder. Voor die elementen is het mogelijk om de octetregel te "overtreden" en dat zullen ze ook doen als dat een gunstigere structuur oplevert. Vandaar ook dat je SO
42- vaak met dubbele bindingen worden geschreven. Maar voor elementen uit de tweede periode kan dat weer niet, en bijvoorbeeld NO
3- moet je schrijven met 1 dubbele binding en 2 enkele bindingen; er is dan een formele lading van 1+ op het N-atoom en 2 formele 1- ladingen op 2 O-atomen; het derde O-atoom is neutraal. Je mag deze structuur niet schrijven met 2 dubbele bindingen zodat de formele lading op N 0 wordt.
Volgens de theorie van Lewis zou PCl
5 niet kunnen bestaan, jammer dat die in je boek staat als voorbeeld.
En mag ik aub nog iets vragen (want ik ben compleet in de war ivm soorten ladingen), er zijn actuele ladingen, partiele ladingen en formele ladingen. De actuele ladingen duiden de werkelijke lading van een atoom aan. Bijvoorbeeld bij NaCl weten we dat Na zijn e- compleet afstaat aan Cl daardoor hebben we actuele ladingen. Bij moleculen waar covalente bindingen heersen is dat niet het geval, want er worden electronen gemeenschappelijk gesteld waardoor actuele ladingen niet mogelijk zijn en partiele ladingen oftewel formele ladingen een alternatief bieden. Formele ladingen zijn een alternatief terwijl ze eigenlijk niet de werkelijke lading van de atomen in moleculen vertegenwoordigen.
Formele ladingen zijn ladingen die in de structuur worden aangeduid "om het kloppend te maken". Als een atoom wordt omringd door evenveel elektronen als hij protonen in de kern heeft, is hij neutraal. Teken je iets anders, dan betekent dat in feite:
als de structuur is zoals je hem tekent, dan zit er daar en daar een lading. Dat is handig, want als er overal ladingen opduiken, dan betekent dat waarschijnlijk dat er iets niet klopt.
De formele ladingen bestaan alleen op papier. (eigenlijk net zoals bindingen alleen op papier bestaan. We tekenen een streepje, maar dat is ook maar een vereenvoudigde weergave van de werkelijkheid. Dat streepje vertelt immers ook niet dat het ene atoom vaak harder aan de elektronen trekt (=elektronegatiever is) dan de andere)
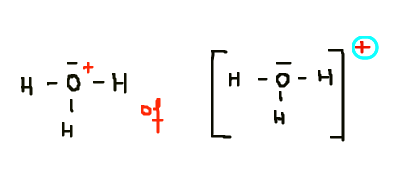
Dus als je op papier een lading tekent (1+ in het H
3O
+ ion bijvoorbeeld), dan is dat altijd een formele lading.
Hoe groot de reële lading is valt bijna niet te zeggen; het enige wat je vaak weet is dat ergens een partiële lading op zit. Je weet dan dat iets "een beetje positief" of "een beetje negatief" geladen is, en dat geef je soms weer. Maar de precieze waarde is enkel te berekenen met ingewikkelde methodes.