[scheikunde] Practicum welk natriumzout
Moderators: ArcherBarry, Fuzzwood
-
- Berichten: 32
Practicum welk natriumzout
Wij moeten een practicum voorbereiden waarin we erachter moeten komen welk natriumzout wij hebben gekregen. Het gaat als volgt:
We krijgen een maatkalf met een zout van natrium en een éénwaardig zuur. De molecuulmassa hiervan ligt tussen de 100-160u, inclusief eventueel kristalwater.
We maken een homogene oplossing van 100ml en meten de pH hiervan. Vervolgens pipetteren we 10ml naar een erlenmeyer. Hier moeten wij een indicator bij toevoegen (welke? keuze uit: methyloranje, fenolftaleïne en een aantal anderen die we te horen krijgen aan het begin van het practicum).
Bij deze oplossing gaan wij met een buret 2-3 keer ~0,10M NaOH titreren.
Nou heb ik twee vragen:
1. Welke indicator moeten wij gebruiken
2. Hoe komen wij er nou uiteindelijk achter welk zout wij gekregen hebben?
We krijgen een maatkalf met een zout van natrium en een éénwaardig zuur. De molecuulmassa hiervan ligt tussen de 100-160u, inclusief eventueel kristalwater.
We maken een homogene oplossing van 100ml en meten de pH hiervan. Vervolgens pipetteren we 10ml naar een erlenmeyer. Hier moeten wij een indicator bij toevoegen (welke? keuze uit: methyloranje, fenolftaleïne en een aantal anderen die we te horen krijgen aan het begin van het practicum).
Bij deze oplossing gaan wij met een buret 2-3 keer ~0,10M NaOH titreren.
Nou heb ik twee vragen:
1. Welke indicator moeten wij gebruiken
2. Hoe komen wij er nou uiteindelijk achter welk zout wij gekregen hebben?
-
- Berichten: 49
Re: Practicum welk natriumzout
De keuze van de indicator hangt af van wat jij wilt weten; moet de indicator omslaan als het zuur of basisch is?
Aangezien je begint met een zuur en natroonloog-oplossing toevoegt, wordt je oplossing basisch.
Methyloranje slaat om in het zure gebied, fenolftale"ine in het basische gebied, dus welke indicator lijkt je dan verstandig om te gebruiken?
Waarom meet je de pH van de oplossing?
Aangezien je begint met een zuur en natroonloog-oplossing toevoegt, wordt je oplossing basisch.
Methyloranje slaat om in het zure gebied, fenolftale"ine in het basische gebied, dus welke indicator lijkt je dan verstandig om te gebruiken?
Waarom meet je de pH van de oplossing?
-
- Berichten: 32
Re: Practicum welk natriumzout
De indicator moet dus omslaan als het basisch is.Niels schreef: ↑zo 24 nov 2013, 16:32
De keuze van de indicator hangt af van wat jij wilt weten; moet de indicator omslaan als het zuur of basisch is?
Aangezien je begint met een zuur en natroonloog-oplossing toevoegt, wordt je oplossing basisch.
Met de pH kan je achter de H3O+ concentratie komen.
-
- Berichten: 49
Re: Practicum welk natriumzout
Je kan de H3O+ concentratie inderdaad bepalen, door de pH te meten.
Zou je dan ook de pKa kunnen berekenen? Zo ja, hoe?
Zou je dan ook de pKa kunnen berekenen? Zo ja, hoe?
-
- Berichten: 32
Re: Practicum welk natriumzout
De Kz waarde kan dan ook berekend worden ja:Niels schreef: ↑zo 24 nov 2013, 17:06
Je kan de H3O+ concentratie inderdaad bepalen, door de pH te meten.
Zou je dan ook de pKa kunnen berekenen? Zo ja, hoe?
Kz=([H3O+]*[Z-])/[HZ]
En de [HZ] is dan [HZ]begin-[H3O]+
Maar moet ik nou voor elk mogelijk zout het gaan proberen?
-
- Berichten: 49
Re: Practicum welk natriumzout
Ik vermoed dat zodra je de pKaof in jouw geval de pKz weet, je deze kan opzoeken op internet (referentie) en dan weet je met welk zuur / natriumzout je te maken hebt.
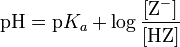
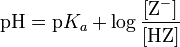
-
- Berichten: 32
Re: Practicum welk natriumzout
Dankjewel Niels, ik kan de Kz en pKz in mijn binas vinden.
-
- Berichten: 49
Re: Practicum welk natriumzout
Mooi. Zijn hiermee beide vragen beantwoord? 
Overigens vermoed ik dat je berekende pKz-waarde enigszins afwijkt van de waarde die in je binas vermeldt staat.
Overigens vermoed ik dat je berekende pKz-waarde enigszins afwijkt van de waarde die in je binas vermeldt staat.
-
- Berichten: 32
Re: Practicum welk natriumzout
Ja. De omslagwaarde van indicatoren kan ik ook in mijn binas vinden.