[scheikunde] Reactiepijlen
Moderators: ArcherBarry, Fuzzwood
- Berichten: 1.129
Reactiepijlen
Ik besefte dit: Als we een evenwichtsreactie zoals bijvoorbeeld H2 + I2 <---> 2HI hebben, kunnen we de reactie in de voorwaartse reactie te splitsen: H2 + I2 ---> 2HI en de omgekeerde reactie H2 + I2 <- - 2HI. Maar nu heb ik geleerd dat een reactie met behulp van een pijl als "--->" of "<---" een complete reactie is. Dus in beide gevallen zou je eigenlijk denken dat ze allebei complete reacties zijn terwijl ze dat niet zijn! Het is een evenwichtsreactie.
Hoe kom ik hier uit?
Bedankt!
Hoe kom ik hier uit?
Bedankt!
- Berichten: 2.455
Re: Reactiepijlen
in welke context ben je bezig?
Immers is uiteindelijk elke reactie een evenwicht, dat men sommige reacties alsnog als "aflopend" noteert is omdat dit voor het gestelde doel een voldoende accurate weergave is
Immers is uiteindelijk elke reactie een evenwicht, dat men sommige reacties alsnog als "aflopend" noteert is omdat dit voor het gestelde doel een voldoende accurate weergave is
This is weird as hell. I approve.
- Berichten: 85
Re: Reactiepijlen
Theoretisch gesproken zou eigenlijk elke reactie een evenwicht vormen. Maar omdat het evenwicht zo zwaar naar één kant ligt, zijn de stoffen die niet reageren in verhouding van volume of aantal mol zo klein, dat het praktisch verwaarloosbaar is.
En het zijn wel degelijk complete reacties.
Het kenmerk van een evenwicht, is dat het dynamisch of statisch kan zijn. Het geval waar jij nu van spreekt is volgens mij een dynamisch evenwicht. Het is constant in beweging.
Dit betekent dat er non stop een reactie naar --> die kant is, maar er is een evengrote reactiesnelheid naar <-- die kant, waardoor de stoffen een evenwicht vormen.
(Dit is wat ik er van maak met mijn scheikunde kennis. Mensen met meer verstand van dit onderwerp: Please correct me if i'm wrong!)
En het zijn wel degelijk complete reacties.
Het kenmerk van een evenwicht, is dat het dynamisch of statisch kan zijn. Het geval waar jij nu van spreekt is volgens mij een dynamisch evenwicht. Het is constant in beweging.
Dit betekent dat er non stop een reactie naar --> die kant is, maar er is een evengrote reactiesnelheid naar <-- die kant, waardoor de stoffen een evenwicht vormen.
(Dit is wat ik er van maak met mijn scheikunde kennis. Mensen met meer verstand van dit onderwerp: Please correct me if i'm wrong!)
Think like a proton, and stay positive.
- Berichten: 2.455
Re: Reactiepijlen
het is maar een notatie, en notatie staat steeds ten dienste van het verhaal dat je te vertellen hebt
This is weird as hell. I approve.
- Berichten: 1.129
Re: Reactiepijlen
Ik snap het "-->" staat ten dienste van het verhaal dat je te vertellen hebt, dus betekent dat dat "-->" niet altijd 100% moet betekenen dat het een complete reactie is. Dit voorbeeld met HI is zeker geen aflopende reactie, maar er staat een "--->" wat niet betekent "aflopend" maar gewoon " reactie naar rechts" en dat is het verhaal dat we hier te vertellen hebben dus. Ben ik ongeveer correct?
Bedankt op voorhand!
Ow Ik heb nog een vraagje! voor :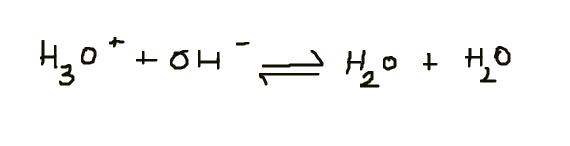
Ik heb gelezen dat als K heel klein is of heel groot is , dan is de reactie aflopend, dus mag je het met een "-->" pijl voorstellen. Nu de concentratie van H30+ & OH- in water is HEEL klein. Betekent dit niet dat het een aflopende reactie is en zo mag geschreven worden?:
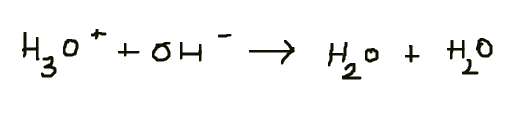
Bedankt op voorhand!
Ow Ik heb nog een vraagje! voor :
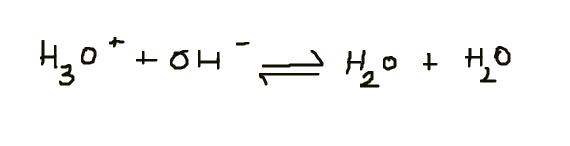
Ik heb gelezen dat als K heel klein is of heel groot is , dan is de reactie aflopend, dus mag je het met een "-->" pijl voorstellen. Nu de concentratie van H30+ & OH- in water is HEEL klein. Betekent dit niet dat het een aflopende reactie is en zo mag geschreven worden?:
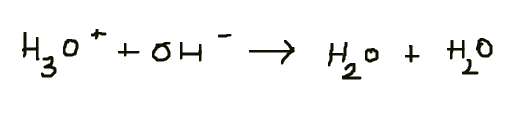
- Berichten: 11.177
Re: Reactiepijlen
In feite wel, alleen met pH berekeningen heel dicht rond de 7 dien je hier rekening mee te houden. Sterke zuren en basen zijn er overigens op gebaseerd dat de door jouw gestelde reactie aflopend is. Immers zijn dat de deeltjes die in water gevormd worden op het moment dat je met zuren met pKa<0 en basen met pKa>14 werken gaat.
- Berichten: 1.129
Re: Reactiepijlen
Als dit dus een aflopende reactie is, waarom staat H3O dan niet in de categorie sterke zuren in de tabel:
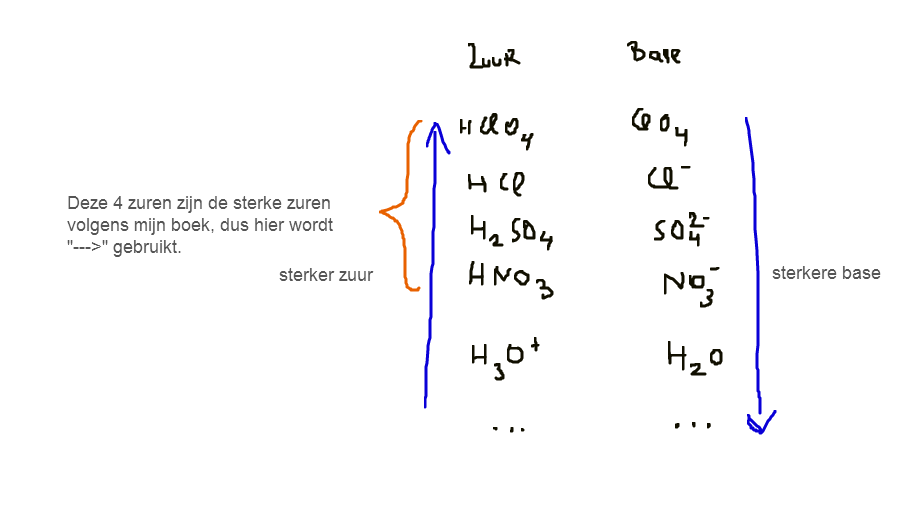
Er is trouwens iemand in een chat die vroeger zei dat K hier niet klein genoeg is voor een complete reactie, dus is de waarde niet klein genoeg om als een complete reactie beschouwd te worden. Volgens hem was het dus niet een complete reactie, Wat denkt u hiervan? Dit is dus een zeer fragiele zaak!
Dit zou ook een mogelijkheid kunnen zijn, want H30 in dit tabel behoort niet tot de sterke zuren, bijna, maar niet! Dus zijn theorie zou overeenkomen met wat er in het tabel staat.
PS (Ik weet dat complete reacties ook met een evenwichtspijl kunnen worden aangeduid)

Er is trouwens iemand in een chat die vroeger zei dat K hier niet klein genoeg is voor een complete reactie, dus is de waarde niet klein genoeg om als een complete reactie beschouwd te worden. Volgens hem was het dus niet een complete reactie, Wat denkt u hiervan? Dit is dus een zeer fragiele zaak!
Dit zou ook een mogelijkheid kunnen zijn, want H30 in dit tabel behoort niet tot de sterke zuren, bijna, maar niet! Dus zijn theorie zou overeenkomen met wat er in het tabel staat.
PS (Ik weet dat complete reacties ook met een evenwichtspijl kunnen worden aangeduid)
- Berichten: 11.177
Re: Reactiepijlen
Wat vormen de stoffen die jij noemt zodra ze met water in contact komen, even stellend dat je ze uberhaubt in watervrije vorm hebt? Wat is in water dus altijd het meest zure deeltje?
- Berichten: 10.563
Re: Reactiepijlen
Of je het moet schrijven als een evenwicht of kunt schrijven als een aflopende reactie hangt van de situatie af. Wil jehet waterevenwicht, dus de autoprotolyse van water in H+ en OH- beschrijven, dan gáát het om het evewicht. De reactie is dan
H2O H+ + OH-
Dat moet je ook zó opschrijven, en niet anders. Het ís niet zo dat enkel de teruggaande reactie optreedt, de situatie is dat een deel van het water splitst in ionen, en dát is wat je wil weergeven. Met een evenwichtspijl dus. In hoeverre dat gebeurt kun je aangeven met de evenwichtsconstante.
Een andere reactie waarbij dezelfde deeltjes zijn betrokken is die tussen een sterk zuur en een sterke base. Gaat het om de reactie tussen een sterk zuur en een sterke base, dan geef je die aan met
H+ + OH- H2O
Bij dergelijke reacties is op het moment dat je beide stoffen samenbrengt in verhouding erg veel OH- en H+ aanwezig. Je zit dan heel erg ver buiten de evenwichtssituatie. De reactie zal dan voor het overgrote deel in de richting van de vorming van H2O lopen - om het evenwicht te herstellen. De teruggaande reactie treedt in verhouding nauwelijks op. Vrijwel alle OH- en H+ die aanwezig waren zijn na afloop van de reactie omgezet. De reactie wordt dan beschouwd als aflopend en wordt weergegeven met een enkele pijl.
Dus: zoals ook eerder aangegeven is de enkele of dubbele pijl een manier om aan te geven wat er gebeurt. Een reactie kan altijd 2 kanten op lopen, het zijn de omstandigheden die bepalen of de reactie voornamelijk de ene of voornamelijk de andere kant op loopt, of iets er tussen. Het zijn dan ook de omstandigheden die bepalen of een enkele of een dubbele pijl op zijn plaats is.
De reden dat H3O+ niet tussen de sterke zuren staat heeft te maken met definitie. Een sterk zuur is een zuur dat sterk genoeg is om H2O te protoneren. Dat is de definitie. H3O+ ís geprotoneerd H2O en kan dus geen H2O protoneren. Schrijf anders de hypothetische reactie tussen beide stoffen maar eens op, je zult zien dat daar niets zinnigs uitkomt.
Wat "iemand op de chat" zegt is in dat verband niet zo relevant. Probeer alsjeblieft niet om, met jou als tussenpersoon, een discussie tussen de chat en dit forum op te zetten c.q. iemand op het forum iets te laten zeggen over jouw verwoording van andermans uitspraken die ook niet verder terug te vinden zijn. Dat leidt helemaal nergens toe.
H2O H+ + OH-
Dat moet je ook zó opschrijven, en niet anders. Het ís niet zo dat enkel de teruggaande reactie optreedt, de situatie is dat een deel van het water splitst in ionen, en dát is wat je wil weergeven. Met een evenwichtspijl dus. In hoeverre dat gebeurt kun je aangeven met de evenwichtsconstante.
Een andere reactie waarbij dezelfde deeltjes zijn betrokken is die tussen een sterk zuur en een sterke base. Gaat het om de reactie tussen een sterk zuur en een sterke base, dan geef je die aan met
H+ + OH- H2O
Bij dergelijke reacties is op het moment dat je beide stoffen samenbrengt in verhouding erg veel OH- en H+ aanwezig. Je zit dan heel erg ver buiten de evenwichtssituatie. De reactie zal dan voor het overgrote deel in de richting van de vorming van H2O lopen - om het evenwicht te herstellen. De teruggaande reactie treedt in verhouding nauwelijks op. Vrijwel alle OH- en H+ die aanwezig waren zijn na afloop van de reactie omgezet. De reactie wordt dan beschouwd als aflopend en wordt weergegeven met een enkele pijl.
Dus: zoals ook eerder aangegeven is de enkele of dubbele pijl een manier om aan te geven wat er gebeurt. Een reactie kan altijd 2 kanten op lopen, het zijn de omstandigheden die bepalen of de reactie voornamelijk de ene of voornamelijk de andere kant op loopt, of iets er tussen. Het zijn dan ook de omstandigheden die bepalen of een enkele of een dubbele pijl op zijn plaats is.
De reden dat H3O+ niet tussen de sterke zuren staat heeft te maken met definitie. Een sterk zuur is een zuur dat sterk genoeg is om H2O te protoneren. Dat is de definitie. H3O+ ís geprotoneerd H2O en kan dus geen H2O protoneren. Schrijf anders de hypothetische reactie tussen beide stoffen maar eens op, je zult zien dat daar niets zinnigs uitkomt.
Wat "iemand op de chat" zegt is in dat verband niet zo relevant. Probeer alsjeblieft niet om, met jou als tussenpersoon, een discussie tussen de chat en dit forum op te zetten c.q. iemand op het forum iets te laten zeggen over jouw verwoording van andermans uitspraken die ook niet verder terug te vinden zijn. Dat leidt helemaal nergens toe.
Cetero censeo Senseo non esse bibendum
- Berichten: 1.129
Re: Reactiepijlen
Bedankt voor de uitleg marko, maar waarom hebt u H+ vervangen door H3O+? Ik heb H3O+ staan, ik weet wel dat ze kunnen overgaan, maar in waterige oplossing heb je toch zowel H+ & H3O+:

En u had geschreven:

En uw definitie van een sterke zuur: "Een sterk zuur is een zuur dat sterk genoeg is om H2O te protoneren" moet dat niet "Een sterk zuur is een zuur dat sterk genoeg is om H2O 100% te protoneren" Betekent dit dat H3O+ een sterk zuur is als HClO4 , HCl, H2SO4, HNO3, HI & HBr? Want enkel bij sterke zuren mag je "--->" gebruiken, de rest is in evenwicht.

En u had geschreven:

En uw definitie van een sterke zuur: "Een sterk zuur is een zuur dat sterk genoeg is om H2O te protoneren" moet dat niet "Een sterk zuur is een zuur dat sterk genoeg is om H2O 100% te protoneren" Betekent dit dat H3O+ een sterk zuur is als HClO4 , HCl, H2SO4, HNO3, HI & HBr? Want enkel bij sterke zuren mag je "--->" gebruiken, de rest is in evenwicht.
- Berichten: 1.129
Re: Reactiepijlen
Ik wil nog iets bijzeggen wat mijn tekst^^ samenvat: Bedoelt u gewoon dat mn boek een fout heeft gemaakt, H3O+ is dus degelijk wel een sterk zuur en zou daartoe moeten behoren. Mijn boek zegt dat enkel de zuren die boven H30+ staan "--->" gebruiken, de rest die onder deze categorie "sterke zuren" staat is in evenwicht met water of met een andere base die tussen base H20 & OH- liggen.
- Berichten: 10.563
Re: Reactiepijlen
"Vrij" H+ komt in water bijna niet voor. Het H+ zit gebonden aan H2O. Vandaar dat mensen het soms weergeven als H3O+. Maar het zit niet specifiek gebonden aan 1 molecuul, gebonden aan 2 moleculen (H5O2+) komt ook voor, en nog wat andere verschijningsvormen. Het heeft dus ook niet zoveel meerwaarde om het aan te duiden als H3O+. Uiteindelijk draait het bij zuur-basereacties om het overdragen van het H+. In de praktijk maakt het 0,0 verschil of je de ene of de andere notatie gebruikt, als je maar zorgt dat je bij gebruik van H3O+ ook een extra H2O aan de andere kant van de pijl hebt staan.
De definitie de ik gaf was een beetje te losjes. Formeel draait het erom dat bij sterke zuren het reactie-evenwicht in de reactie met water rechts ligt. Er is dus wel een evenwicht, maar dat licht heel sterk aan de rechterkant. De sterke zuren die we kennen zijn allemaal zo sterk dat de reactie met water zelfs bijna aflopend is: vrijwel al het zuur wordt gesplitst in ionen. Daarom geven we dat weer met een aflopende pijl.
Voor H3O+ en H2O heeft het geen zin om een reactie tussen beide te definiëren (de reactieproducten zijn dezelfde als de beginstoffen). Zelfs al zou je een reactie opschrijven, dan is het per definitie een evenwicht, met als evenwichtsconstante 1. Het evenwicht ligt precies in het midden, en dus niet aan de rechterkant zoals de definitie van sterke zuren vraagt.
Vandaar dat H3O+ niet tussen de sterke zuren in de tabel staat.
Maar pas op dat je je door dit soort discussies over formaliteiten niet laat afleiden door het voornaamste punt:
Zuur-basereacties met sterke zuren zijn aflopend, die geven we weer met een enkele pijl. Een sterk zuur komt in water voor als losse ionen, en die komen dan ook in de reactievergelijking voor. Sommige mensen schrijven dan H+ en sommige mensen gebruiken H3O+.
In zo'n aflopende reactie van een sterk zuur schrijf je dus:
H<sup>+</sup> + B<sup>-</sup> <fa_right/> HB[chem] of [chem]H<sub>3</sub>O<sup>+</sup> + B<sup>-</sup> <fa_right/> HB + H<sub>2</sub>O
Dus: Als er een sterk zuur aanwezig is, is er een aflopende reactie en moet je H+ of H3O+ gebruiken, omdat het sterke zuur in die vorm aanwezig is.
Het omgekeerde (zoals jij het in een eerder bericht formuleerde) is dus niet juist om te zeggen: Bij H3O+ moet ik een aflopende pijl gebruiken, dus is het een sterk zuur.
De definitie de ik gaf was een beetje te losjes. Formeel draait het erom dat bij sterke zuren het reactie-evenwicht in de reactie met water rechts ligt. Er is dus wel een evenwicht, maar dat licht heel sterk aan de rechterkant. De sterke zuren die we kennen zijn allemaal zo sterk dat de reactie met water zelfs bijna aflopend is: vrijwel al het zuur wordt gesplitst in ionen. Daarom geven we dat weer met een aflopende pijl.
Voor H3O+ en H2O heeft het geen zin om een reactie tussen beide te definiëren (de reactieproducten zijn dezelfde als de beginstoffen). Zelfs al zou je een reactie opschrijven, dan is het per definitie een evenwicht, met als evenwichtsconstante 1. Het evenwicht ligt precies in het midden, en dus niet aan de rechterkant zoals de definitie van sterke zuren vraagt.
Vandaar dat H3O+ niet tussen de sterke zuren in de tabel staat.
Maar pas op dat je je door dit soort discussies over formaliteiten niet laat afleiden door het voornaamste punt:
Zuur-basereacties met sterke zuren zijn aflopend, die geven we weer met een enkele pijl. Een sterk zuur komt in water voor als losse ionen, en die komen dan ook in de reactievergelijking voor. Sommige mensen schrijven dan H+ en sommige mensen gebruiken H3O+.
In zo'n aflopende reactie van een sterk zuur schrijf je dus:
H<sup>+</sup> + B<sup>-</sup> <fa_right/> HB[chem] of [chem]H<sub>3</sub>O<sup>+</sup> + B<sup>-</sup> <fa_right/> HB + H<sub>2</sub>O
Dus: Als er een sterk zuur aanwezig is, is er een aflopende reactie en moet je H+ of H3O+ gebruiken, omdat het sterke zuur in die vorm aanwezig is.
Het omgekeerde (zoals jij het in een eerder bericht formuleerde) is dus niet juist om te zeggen: Bij H3O+ moet ik een aflopende pijl gebruiken, dus is het een sterk zuur.
Cetero censeo Senseo non esse bibendum
- Berichten: 1.129
Re: Reactiepijlen
Ik snap niet hoe alle H+ omzet naar H30 als het evenwicht naar links ligt in:

Ik heb dit in mijn boek gevonden :
"Een base is een deeltje dat een proton opneemt:"

En het tabel zegt voor SO42- : erg zwakke base , maar er staat wel een aflopende pijl hierboven!

Ik heb dit in mijn boek gevonden :
"Een base is een deeltje dat een proton opneemt:"

En het tabel zegt voor SO42- : erg zwakke base , maar er staat wel een aflopende pijl hierboven!
- Berichten: 10.563
Re: Reactiepijlen
Het evenwicht dat je hier tekent ligt niet links.mcfaker123 schreef: ↑vr 10 jan 2014, 20:09
Ik snap niet hoe alle H+ omzet naar H30 als het evenwicht naar links ligt in:
kan opnemen.Ik heb dit in mijn boek gevonden :
"Een base is een deeltje dat een proton opneemt:"

Een reactie tussen een zwakke base en een sterk zuur is aflopend. De reactie met SO42- kan dus prima. Bovendien is SO42- geen erg zwakke base. Sterker nog, van alle zwakke basen is het een van de minst zwakke.En het tabel zegt voor SO42- : erg zwakke base , maar er staat wel een aflopende pijl hierboven!
Of je de onderste 3 reacties als evenwicht moet schrijven of met een enkele pijl hangt af van de omstandigheden. Met aan de linkerkant H+ en aan de rechterkant het zwakke zuur wijst normaal op een reactie tussen de base en een sterk zuur, aflopend dus. Geen evenwichtspijl nodig.
Cetero censeo Senseo non esse bibendum
- Berichten: 1.129
Re: Reactiepijlen
H2O is de zevende zwakste base van al mn 45 basen! het staat onder "heel zwakke basen" en boven " uiterst zwakke basen".
H3O+ is nummer 7 sterkste zuur van mn 45 zuren! Dus dit doet mij vermoeden dat het evenwicht naar links ligt. Waarom zegt u dat het niet links ligt?

Dit zijn toch geen zuur-base reacties. H+ is geen zuur, er wordt gewoon een proton opgenomen door een base.
Een voorbeeld van een zuur-base reactie is :
"Of je de onderste 3 reacties als evenwicht moet schrijven of met een enkele pijl hangt af van de omstandigheden. Met aan de linkerkant H+ en aan de rechterkant het zwakke zuur wijst normaal op een reactie tussen de base en een sterk zuur, aflopend dus. Geen evenwichtspijl nodig. "
Maar er staan daar wel degelijk evenwichtspijlen, en er omtrent dat u zegt "het hangt af van de omstandigheden" , dit zijn gewoon de voorbeelden. Ze zijn allemaal bij elkaar genoteerd onder "Een base is een deeltje dat een proton kan opnemen"
Ook heb ik dit gemerkt:

Ik ben geen fan van chemie, want hoe meer ik ernaar kijk, hoe meer in de war ik kom tot op het punt waar ik tegen mezelf moet zeggen dat ik helemaal niet meer snap terwijl ik aannam dat ik het snapte de eerste keer dat ik de tekst las. Ik ontdek altijd wel iets in het boek dat heel de theorie ondermijnt.
H3O+ is nummer 7 sterkste zuur van mn 45 zuren! Dus dit doet mij vermoeden dat het evenwicht naar links ligt. Waarom zegt u dat het niet links ligt?

Dit zijn toch geen zuur-base reacties. H+ is geen zuur, er wordt gewoon een proton opgenomen door een base.
Een voorbeeld van een zuur-base reactie is :

"Of je de onderste 3 reacties als evenwicht moet schrijven of met een enkele pijl hangt af van de omstandigheden. Met aan de linkerkant H+ en aan de rechterkant het zwakke zuur wijst normaal op een reactie tussen de base en een sterk zuur, aflopend dus. Geen evenwichtspijl nodig. "
Maar er staan daar wel degelijk evenwichtspijlen, en er omtrent dat u zegt "het hangt af van de omstandigheden" , dit zijn gewoon de voorbeelden. Ze zijn allemaal bij elkaar genoteerd onder "Een base is een deeltje dat een proton kan opnemen"
Ook heb ik dit gemerkt:

Ik ben geen fan van chemie, want hoe meer ik ernaar kijk, hoe meer in de war ik kom tot op het punt waar ik tegen mezelf moet zeggen dat ik helemaal niet meer snap terwijl ik aannam dat ik het snapte de eerste keer dat ik de tekst las. Ik ontdek altijd wel iets in het boek dat heel de theorie ondermijnt.