[scheikunde] Stabiliteit radicalen
Moderators: ArcherBarry, Fuzzwood
-
- Berichten: 10
Stabiliteit radicalen
Dag allemaal,
Ik snap het volgende niet zo goed.
In mijn boek staat: alkylgroepen stabiliseren radicalen op dezelfde manier als bij carbolkationen, nl. door hyperconjugatie.
Kan iemand mij hyperconjugatie duidelijk uitleggen adhv een voorbeeld voor carbokationen en voor radicalen? Op internet vind ik vooral dat het inhoudt dat een sigma en een pi-binding met elkaar interageren. Maar er is toch geen pi-binding want er is geen dubbele binding aanwezig??
Alvast bedankt
Ik snap het volgende niet zo goed.
In mijn boek staat: alkylgroepen stabiliseren radicalen op dezelfde manier als bij carbolkationen, nl. door hyperconjugatie.
Kan iemand mij hyperconjugatie duidelijk uitleggen adhv een voorbeeld voor carbokationen en voor radicalen? Op internet vind ik vooral dat het inhoudt dat een sigma en een pi-binding met elkaar interageren. Maar er is toch geen pi-binding want er is geen dubbele binding aanwezig??
Alvast bedankt
-
- Berichten: 10
Re: Stabiliteit radicalen
Zou er iemand aub willen reageren. Dit is best dringend.. 
- Berichten: 10.562
Re: Stabiliteit radicalen
Alles op zijn tijd.
Hyperconjugatie behelst de overlap tussen een pi-binding en een sigma-binding of tussen een p-orbitaal en een sigma-binding. Wat je op internet vond klopt dus wel maar is niet compleet. En er zijn nog wat andere mogelijkheden voor hyperconjugatie, maar dit zijn belangrijkste. Waar het op neerkomt is dat een sigma-binding zodanig georiënteerd kan staan dat er overlap is met de pi-binding of met een p-orbitaal.
Die overlap leidt tot stabilisatie als je te maken hebt met een leeg p-orbitaal zoals bij een carbokation of een half gevuld p-orbitaal zoals bij een radicaal. In die gevallen bevat het orbitaal minder elektronen dan gewenst, en de overlap met een ander orbitaal compenseert dat.
Hyperconjugatie behelst de overlap tussen een pi-binding en een sigma-binding of tussen een p-orbitaal en een sigma-binding. Wat je op internet vond klopt dus wel maar is niet compleet. En er zijn nog wat andere mogelijkheden voor hyperconjugatie, maar dit zijn belangrijkste. Waar het op neerkomt is dat een sigma-binding zodanig georiënteerd kan staan dat er overlap is met de pi-binding of met een p-orbitaal.
Die overlap leidt tot stabilisatie als je te maken hebt met een leeg p-orbitaal zoals bij een carbokation of een half gevuld p-orbitaal zoals bij een radicaal. In die gevallen bevat het orbitaal minder elektronen dan gewenst, en de overlap met een ander orbitaal compenseert dat.
Cetero censeo Senseo non esse bibendum
-
- Berichten: 10
Re: Stabiliteit radicalen
Marko schreef: Alles op zijn tijd.
Hyperconjugatie behelst de overlap tussen een pi-binding en een sigma-binding of tussen een p-orbitaal en een sigma-binding. Wat je op internet vond klopt dus wel maar is niet compleet. En er zijn nog wat andere mogelijkheden voor hyperconjugatie, maar dit zijn belangrijkste. Waar het op neerkomt is dat een sigma-binding zodanig georiënteerd kan staan dat er overlap is met de pi-binding of met een p-orbitaal.
Die overlap leidt tot stabilisatie als je te maken hebt met een leeg p-orbitaal zoals bij een carbokation of een half gevuld p-orbitaal zoals bij een radicaal. In die gevallen bevat het orbitaal minder elektronen dan gewenst, en de overlap met een ander orbitaal compenseert dat.
En op welke manier is een sigma-binding met een alkylgroep gunstiger voor een betere stabiliteit?
Bedankt voor je reactie alvast.
- Berichten: 10.562
Re: Stabiliteit radicalen
Dat C-atoom van de alkylgroep maakt 3 bindingen. Er is altijd wel een van die bindingen die parallel staat aan het p-orbitaal. Zie bijvoorbeeld dit plaatje:
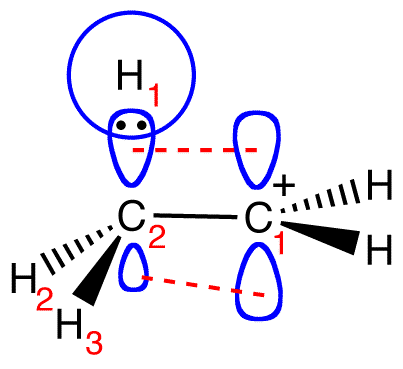
Maar ik kan me niet voorstellen dat er in je boek geen vergelijkbaar plaatje staat.
Dit plaatje toont een carbokation, maar stabilisatie van een radicaal werkt op precies dezelfde manier, alleen zit er dan 1 elektron in het radicaal en bij een carbokation 0.

Maar ik kan me niet voorstellen dat er in je boek geen vergelijkbaar plaatje staat.
Dit plaatje toont een carbokation, maar stabilisatie van een radicaal werkt op precies dezelfde manier, alleen zit er dan 1 elektron in het radicaal en bij een carbokation 0.
Cetero censeo Senseo non esse bibendum
-
- Berichten: 10
Re: Stabiliteit radicalen
Marko schreef: Dat C-atoom van de alkylgroep maakt 3 bindingen. Er is altijd wel een van die bindingen die parallel staat aan het p-orbitaal. Zie bijvoorbeeld dit plaatje:
Maar ik kan me niet voorstellen dat er in je boek geen vergelijkbaar plaatje staat.
Dit plaatje toont een carbokation, maar stabilisatie van een radicaal werkt op precies dezelfde manier, alleen zit er dan 1 elektron in het radicaal en bij een carbokation 0.
Er staan wel soortgelijke plaatjes in, alleen vind ik de achtergronduitleg best vaag in mijn boek. Het is nu wat duidelijker, dankje.