[scheikunde] Aantal vragen betreft redoxreacties
Moderators: ArcherBarry, Fuzzwood
-
- Berichten: 24
Aantal vragen betreft redoxreacties
Hallo,
Ik ben een leerling uit VWO6 en ben me nu aan het voorbereiden op de laatste schoolexamens, ik hoop graag geholpen te kunnen worden bij de plekken waar ik vast ben gelopen.
1) In binas tabel 48 ben ik de volgende halfreacties tegengekomen van HNO3:
Die van verdund salpeterzuur: NO3− + 4H+ + 3e- -> NO + 2 H2O
Die van geconcentreerd salpeterzuur: NO3− + 2H+ + e- -> NO2 + H2O
Maar er staat er nog een in, namelijk: NO3− + 3H+ + 2e- -> HNO2 + H2O en ik vroeg me af wanneer je met die halfreactie te maken hebt?
2) "De kapper voegt ammonia toe om te schubben van het haar uiteen te laten gaan, maar ammonia heeft ook invloed op de sterkte van H2O2 als reductor. Waterstofperoxide reageert hier als reductor; er is dus een oxidator nodig: H2O2 zelf."
Nu moet ik de vergelijking van deze halfreactie opstellen. H2O2 is de reductor en neemt dus elektronen op. Het is mij dus duidelijk wat er voor de pijl komt, maar hoe kom ik erachter wat er na de pijl moet?
(Het antwoord is: H2O2 + 2 e− → 2 OH−)
3) CaH2(s) + 2 H2O(l) → Ca2+(aq) + 2 OH−(aq) + 2 H2(g) dit is volgens mijn boek een redoxreactie, maar ik snap niet waarom. Ik zie namelijk geen elektronenoverdracht, maar enkel dat er 2 protonen van het watermolecuul "weggaan"(?).
4) "Stel aan de hand van halfreacties de vergelijking op van de reactie tussen ethanol en zuurstof in zuur milieu" Hier loop ik eigenlijk al meteen in de knoop. Ik weet namelijk niet hoe ik aan de halfreactie van ethanol moet komen, aangezien er in T48 alleen ionen staan, kan ik hem daar dus ook niet vinden. En bij het kiezen van de halfreactie van zuurstof twijfelde ik ook, ik weet namelijk niet welke ik moet pakken aangezien er 2 in binas staan. Namelijk: O2(g) + 4 H+ + 4 e− → 2 H2O(l) en O2(g) + 2 H+ + 2 e− → H2O2(l)
Beide halfreacties bevinden zich in een zuur milieu, alleen de ene heeft een hogere standaardelektrodepotentiaal, is dat dan ook meteen de beslissende factor?
Alvast mijn dank naar degene die me verder kan helpen hiermee!
Ik ben een leerling uit VWO6 en ben me nu aan het voorbereiden op de laatste schoolexamens, ik hoop graag geholpen te kunnen worden bij de plekken waar ik vast ben gelopen.
1) In binas tabel 48 ben ik de volgende halfreacties tegengekomen van HNO3:
Die van verdund salpeterzuur: NO3− + 4H+ + 3e- -> NO + 2 H2O
Die van geconcentreerd salpeterzuur: NO3− + 2H+ + e- -> NO2 + H2O
Maar er staat er nog een in, namelijk: NO3− + 3H+ + 2e- -> HNO2 + H2O en ik vroeg me af wanneer je met die halfreactie te maken hebt?
2) "De kapper voegt ammonia toe om te schubben van het haar uiteen te laten gaan, maar ammonia heeft ook invloed op de sterkte van H2O2 als reductor. Waterstofperoxide reageert hier als reductor; er is dus een oxidator nodig: H2O2 zelf."
Nu moet ik de vergelijking van deze halfreactie opstellen. H2O2 is de reductor en neemt dus elektronen op. Het is mij dus duidelijk wat er voor de pijl komt, maar hoe kom ik erachter wat er na de pijl moet?
(Het antwoord is: H2O2 + 2 e− → 2 OH−)
3) CaH2(s) + 2 H2O(l) → Ca2+(aq) + 2 OH−(aq) + 2 H2(g) dit is volgens mijn boek een redoxreactie, maar ik snap niet waarom. Ik zie namelijk geen elektronenoverdracht, maar enkel dat er 2 protonen van het watermolecuul "weggaan"(?).
4) "Stel aan de hand van halfreacties de vergelijking op van de reactie tussen ethanol en zuurstof in zuur milieu" Hier loop ik eigenlijk al meteen in de knoop. Ik weet namelijk niet hoe ik aan de halfreactie van ethanol moet komen, aangezien er in T48 alleen ionen staan, kan ik hem daar dus ook niet vinden. En bij het kiezen van de halfreactie van zuurstof twijfelde ik ook, ik weet namelijk niet welke ik moet pakken aangezien er 2 in binas staan. Namelijk: O2(g) + 4 H+ + 4 e− → 2 H2O(l) en O2(g) + 2 H+ + 2 e− → H2O2(l)
Beide halfreacties bevinden zich in een zuur milieu, alleen de ene heeft een hogere standaardelektrodepotentiaal, is dat dan ook meteen de beslissende factor?
Alvast mijn dank naar degene die me verder kan helpen hiermee!
- Pluimdrager
- Berichten: 2.386
Re: Aantal vragen betreft redoxreacties
1) Ik weet niet onder welke omstandigheden (pH, temperatuur, ....) er eventueel HNO2 kan ontstaan, maar ik denk ook niet dat jij als VWO-er geacht wordt dat te weten. Als je ooit een opgave moet oplossen waabij HNO2 ontstaat dan zal dat ongetwijfeld in de opgave vermeld worden.
Bovendien: HNO2 is een oxidator die NO produceert. Goed mogelijk dat die halfreactie ook in Binas staat. Staat in ieder geval in diverse andere tabellenboeken.
2)
H2O2 kan zowel als oxidator en als reductor optreden. Beide halfreacties staan waarschijnlijk in Binas.
Het vraagstuk is onduidelijk, wellicht omdat wat jij plaatst onvolledig is.
Plaats van een vraagstuk altijd een foto van de volledige opgave.
Dat voorkomt een hoop verwarring en tijdverlies aan onze kant.
3) Ik ken deze specifieke reactie niet, maar laten we er vanuit gaan dat jouw boek correct is. Dan moet je dus twee halfreacties bedenken waarbij in de ene CaH2 overgaat in Ca2+ en H2 en in de andere CaH2 overgaat in Ca2+ en H+
Probeer het eens.
4)
Algemeen: de halfreacties in een tabel met standaardreductiepotentialen staan altijd geschreven als: oxidator + elektronen ---> reductor.
Dat wil echter niet zeggen dat alle halfreacties in de praktijk ook in die richting op kunnen treden.
Om een halfreactie op te stellen hoeft men alleen de belangrijkste stoffen in de reactie te kennen.
Bijvoorbeeld: verdund salpeterzuur als oxidator produceert NO
dus: NO3- + ............. --> NO + ................
Om de rest van de halfreactie toe te voegen gebruikt men eeen aantal simpele stappen:
1) maak O-balans kloppend met H2O
2) maak H-balans kloppend met H+
3) maak lading kloppend met e-
4) als reactie in basisch milieu, voeg dat aan beide zijden OH- toe om H+ te neutraliseren
5) streep overmaat H2O aan beide zijden tegen elkaar weg
Gebruik die stappen in vraagstukken 2), 3) en 4).
Bovendien: HNO2 is een oxidator die NO produceert. Goed mogelijk dat die halfreactie ook in Binas staat. Staat in ieder geval in diverse andere tabellenboeken.
2)
Een reductor neemt geen elektronen op maar staat die juist af.H2O2 is de reductor en neemt dus elektronen op.
H2O2 kan zowel als oxidator en als reductor optreden. Beide halfreacties staan waarschijnlijk in Binas.
Het vraagstuk is onduidelijk, wellicht omdat wat jij plaatst onvolledig is.
Plaats van een vraagstuk altijd een foto van de volledige opgave.
Dat voorkomt een hoop verwarring en tijdverlies aan onze kant.
3) Ik ken deze specifieke reactie niet, maar laten we er vanuit gaan dat jouw boek correct is. Dan moet je dus twee halfreacties bedenken waarbij in de ene CaH2 overgaat in Ca2+ en H2 en in de andere CaH2 overgaat in Ca2+ en H+
Probeer het eens.
4)
Je weet toch wel wat er ontstaat als ethanol geoxideerd (verbrand) wordt?Ik weet namelijk niet hoe ik aan de halfreactie van ethanol moet komen
Neem de eerste. Het zal echt niet gebeuren dat er vanzelf H2O2 ontstaat.En bij het kiezen van de halfreactie van zuurstof twijfelde ik ook, ik weet namelijk niet welke ik moet pakken aangezien er 2 in binas staan.
Algemeen: de halfreacties in een tabel met standaardreductiepotentialen staan altijd geschreven als: oxidator + elektronen ---> reductor.
Dat wil echter niet zeggen dat alle halfreacties in de praktijk ook in die richting op kunnen treden.
Om een halfreactie op te stellen hoeft men alleen de belangrijkste stoffen in de reactie te kennen.
Bijvoorbeeld: verdund salpeterzuur als oxidator produceert NO
dus: NO3- + ............. --> NO + ................
Om de rest van de halfreactie toe te voegen gebruikt men eeen aantal simpele stappen:
1) maak O-balans kloppend met H2O
2) maak H-balans kloppend met H+
3) maak lading kloppend met e-
4) als reactie in basisch milieu, voeg dat aan beide zijden OH- toe om H+ te neutraliseren
5) streep overmaat H2O aan beide zijden tegen elkaar weg
Gebruik die stappen in vraagstukken 2), 3) en 4).
- Pluimdrager
- Berichten: 2.386
Re: Aantal vragen betreft redoxreacties
Lukt het nu?
Indien niet, probeer dan eerst eens voor vraagstuk 4) de halfreactie van ethanol op te stellen met gebruik van de algemene stappen die ik beschreef:
C2H5OH + ........... --> 2 CO2 + .................
Indien niet, probeer dan eerst eens voor vraagstuk 4) de halfreactie van ethanol op te stellen met gebruik van de algemene stappen die ik beschreef:
C2H5OH + ........... --> 2 CO2 + .................
-
- Berichten: 24
Re: Aantal vragen betreft redoxreacties
Sorry, zie nu pas uw reactie! Ik zal het vanavond even proberen.
-
- Berichten: 24
Re: Aantal vragen betreft redoxreacties
2) Geen idee hoe ik de opdracht hier geupload krijg, dus maar via deze weg gedaan: http://s000.tinyupload.com/?file_id=46228173605252834855
3) Dit volg ik niet helemaal, hoe ziet u dat het om die 2 halfreacties gaat? Bovendien snap ik ook nog niet hoe CaH2 ongeladen is, waarom kunnen H-atomen een negatieve lading hebben? Ik kan namelijk nu ook niet meer begrijpen dat waterstof ongeladen is..(hetzelfde geldt dus voor Br2 I2 N2 Cl2 O2 F2) is er dus ergens in mijn basiskennis een gat omdat ik nog steeds denk dat H een + lading heeft?
CaH2 -> Ca2+ + 2H+ + 4e- is de ene halfreactie en CaH2 -> Ca2+ + H2 + 2e- de andere, denk ik?
4) De verbrandingsreactie van ethanol is C2H5OH + 3O2 -> 2CO2 + 3H2O, maar dit is toch niet de reactie die ze bedoelen?
Als ik C2H5OH + ........... --> 2 CO2 + ................. oplos dan krijg ik C2H5OH + 3 H2O--> 2 CO2 + 12H+ + 12e- , waarom denkt u dat er CO2 ontstaat bij de halfreactie van ethanol? De halfreactie die mijn boek voor ethanol geeft is: C2H5OH -> C2H4O + 2H+ + 2e-
Vraag 3 was trouwens naar aanleiding van deze vraag in het boek: http://s000.tinyupload.com/?file_id=06301259241941245897
3) Dit volg ik niet helemaal, hoe ziet u dat het om die 2 halfreacties gaat? Bovendien snap ik ook nog niet hoe CaH2 ongeladen is, waarom kunnen H-atomen een negatieve lading hebben? Ik kan namelijk nu ook niet meer begrijpen dat waterstof ongeladen is..(hetzelfde geldt dus voor Br2 I2 N2 Cl2 O2 F2) is er dus ergens in mijn basiskennis een gat omdat ik nog steeds denk dat H een + lading heeft?
CaH2 -> Ca2+ + 2H+ + 4e- is de ene halfreactie en CaH2 -> Ca2+ + H2 + 2e- de andere, denk ik?
4) De verbrandingsreactie van ethanol is C2H5OH + 3O2 -> 2CO2 + 3H2O, maar dit is toch niet de reactie die ze bedoelen?
Als ik C2H5OH + ........... --> 2 CO2 + ................. oplos dan krijg ik C2H5OH + 3 H2O--> 2 CO2 + 12H+ + 12e- , waarom denkt u dat er CO2 ontstaat bij de halfreactie van ethanol? De halfreactie die mijn boek voor ethanol geeft is: C2H5OH -> C2H4O + 2H+ + 2e-
Vraag 3 was trouwens naar aanleiding van deze vraag in het boek: http://s000.tinyupload.com/?file_id=06301259241941245897
- Pluimdrager
- Berichten: 2.386
Re: Aantal vragen betreft redoxreacties
Bestand uploaden doe je als volgt:
Log in en klik rechtsonder op [Uitgebreid bewerken]
Daarna linksonder op [Browse...]
Daarna linksonder op [Dit bestand uploaden]
Daarna rechtsonder op Invoegen in bericht
2)
Vraag a: geef de halfreactie voor het ontstaan van zuurstof uit H2O2
Dat is toch eenvoudig? Staat waarschijnlijk in Binas en anders doe je het eenvoudig zelf met het stappenplan.
Vraag b: geef de vergelijking van deze halfreactie.
Niet echt duidelijk welke halfreactie bedoeld wordt, maar ik neem aan die waarbij H2O2 als oxidator werkt en er H2O ontstaat.
Ook eenvoudig.
3)
Simpel gezegd: in CaH2 is H de sterkste oxidator en Ca de zwakste, dus is het Ca2+ en H-
Ca2+ doet niets in de reacties dus zullen we dat voor het gemak maar weglaten in de halfreacties.
Simpel gezegd reageert H- met H+ (uit water) tot H2
Dat is op te splitsen in twee halfreacties:
een waarbij H- als reductor werkt en een elektron afstaat waardoor er H2 ontstaat,
en een waarbij H+ als oxidator werkt en een elektron opneemt waardoor er H2 ontstaat. Maar omdat we al weten dat de oplossing basisch wordt moet je die halfreactie daarna herschrijven (stap 4 van stappenplan) zodat H2O het elektron opneemt en er naast H2 ook OH- ontstaat.
4) ethanol kan door O2 geoxideerd worden tot ethanal of azijnzuur of CO2.
Blijkbaar bedoelt de vraagstukbedenker dat er ethanal ontstaat. Tenzij dat in het vraagstuk stond is dat niet simpel te raden.
Log in en klik rechtsonder op [Uitgebreid bewerken]
Daarna linksonder op [Browse...]
Daarna linksonder op [Dit bestand uploaden]
Daarna rechtsonder op Invoegen in bericht
2)
Vraag a: geef de halfreactie voor het ontstaan van zuurstof uit H2O2
Dat is toch eenvoudig? Staat waarschijnlijk in Binas en anders doe je het eenvoudig zelf met het stappenplan.
Vraag b: geef de vergelijking van deze halfreactie.
Niet echt duidelijk welke halfreactie bedoeld wordt, maar ik neem aan die waarbij H2O2 als oxidator werkt en er H2O ontstaat.
Ook eenvoudig.
3)
Simpel gezegd: in CaH2 is H de sterkste oxidator en Ca de zwakste, dus is het Ca2+ en H-
Ca2+ doet niets in de reacties dus zullen we dat voor het gemak maar weglaten in de halfreacties.
Simpel gezegd reageert H- met H+ (uit water) tot H2
Dat is op te splitsen in twee halfreacties:
een waarbij H- als reductor werkt en een elektron afstaat waardoor er H2 ontstaat,
en een waarbij H+ als oxidator werkt en een elektron opneemt waardoor er H2 ontstaat. Maar omdat we al weten dat de oplossing basisch wordt moet je die halfreactie daarna herschrijven (stap 4 van stappenplan) zodat H2O het elektron opneemt en er naast H2 ook OH- ontstaat.
4) ethanol kan door O2 geoxideerd worden tot ethanal of azijnzuur of CO2.
Blijkbaar bedoelt de vraagstukbedenker dat er ethanal ontstaat. Tenzij dat in het vraagstuk stond is dat niet simpel te raden.
-
- Berichten: 24
Re: Aantal vragen betreft redoxreacties
Bedankt! Ik snap het nu al wat beter. Heb nog wel een vraag bij 33, bij d namelijk: het antwoordenboekje geeft als antwoord ja en ik snap de redenatie ook wel; H2O treedt namelijk op als zuur en H− als base (H-is een theoretische base, dus deze reactie verloopt eigenlijk helemaal niet, maar je mag het alsnog een zuurbasereactie noemen?). Als je dit dus ook een zuurbasereactie kan noemen, is het dus een zuurbasereactie én een redoxreactie? Ik heb in mijn lessen altijd geleerd dat het of het een of het ander of een andere reactie is.
-
- Berichten: 24
Re: Aantal vragen betreft redoxreacties
Ik heb nog een aantal vragen..zou u daar misschien ook even naar willen kijken?
5a: Ik zie in de tekst alleen iets staan over een koperelektrode en een magnesiumelektrode, maar hoe komt het antwoordenboekje dan aan de halfreactie van 2 H+ + 2 e− → H2(g)?
Fe + x -> FeCl2 is dan de eerste stap die ik maak, en zou er dan niet gewoon op de plaats van x Cl2 moeten komen te staan?
(Het antwoord is HCl)
De vraag bij deze elektrochemische cel is dat ik moet uitleggen waarom er geen membraan nodig is. Ik snap dat de reductor en oxidator ieder langs een andere elektrode wordt geleid, maar hoezo is het niet mogelijk dat er toch wel deeltjes daardoorheen gaan? Dezelfde vraag had ik bij elektrochemische cellen, die zijn verbonden door een zoutbrug; waarom kunnen er dus ook geen ionen door de zoutbrug in de andere cel komen?
Een zoutbrug kan overigens stoffen vrijlaten (toch?), om ladingen te corrigeren, maar wordt dit gedaan door stoffen waaruit de zoutbrug zelf bestaat of is het dus wel mogelijk dat ionen van de ene halfcel naar de andere cel verplaatsen via de zoutbrug? Beide gevallen kunnen dan toch leiden naar een directe redoxreactie in 1 halfcel? (vandaar dat beide opties onwaarschijnlijk lijken voor mij, maar waarom het niet kan, begrijp ik niet)
Fe + x -> FeCl2 is dan de eerste stap die ik maak, en zou er dan niet gewoon op de plaats van x Cl2 moeten komen te staan?
(Het antwoord is HCl)
De vraag bij deze elektrochemische cel is dat ik moet uitleggen waarom er geen membraan nodig is. Ik snap dat de reductor en oxidator ieder langs een andere elektrode wordt geleid, maar hoezo is het niet mogelijk dat er toch wel deeltjes daardoorheen gaan? Dezelfde vraag had ik bij elektrochemische cellen, die zijn verbonden door een zoutbrug; waarom kunnen er dus ook geen ionen door de zoutbrug in de andere cel komen?
Een zoutbrug kan overigens stoffen vrijlaten (toch?), om ladingen te corrigeren, maar wordt dit gedaan door stoffen waaruit de zoutbrug zelf bestaat of is het dus wel mogelijk dat ionen van de ene halfcel naar de andere cel verplaatsen via de zoutbrug? Beide gevallen kunnen dan toch leiden naar een directe redoxreactie in 1 halfcel? (vandaar dat beide opties onwaarschijnlijk lijken voor mij, maar waarom het niet kan, begrijp ik niet)
- Pluimdrager
- Berichten: 2.386
Re: Aantal vragen betreft redoxreacties
Vraag 33d: H2O is geen zuur. Men zal met zuur-base de reactie H+ + H- bedoelen die ik eerder al gaf.
Dit is dan blijkbaar een uitzondering op de regel.
Vraag 5a: zie jij dan een andere oxidator in het systeem?
Dit is in feite een Volta cel waarbij Zn vervangen is door Mg.
Over Volta cel is op dit forum al vaak geschreven. Gebruik zoekfunctie linksboven.

Dit lijkt niet het volledige vraagstuk.
HCl (zoutzuur) zal Fe oplossen zodat er FeCl2 ontstaat. Daar twijfel je toch niet aan?
Cl2 lost nauwelijks op in water.
Als je twijfelt tussen twee mogelijke antwoorden, lees dan het vraagstuk nog eens zeer aandachtig door ("wanneer opgelost") en als je dan nog twijfelt kies de simpelste oplossing. Je doet immers middelbare school, geen universiteit.
Een membraan of zoutbrug als verbinding tussen twee halfcellen is nodig als voorkomen moet worden dat de verkeerde ionen van links naar rechts en/of van rechts naar links kunnen gaan. Dat is hier niet het geval, er zijn geen storende ionen die gestopt moeten worden.
De juiste zoutbrug bevat niet-storende ionen die langzaam vrijkomen aan z'n beide uiteinden. Alleen als je dezelfde zoutbrug ontzettend lang zou gebruiken dan zouden er storende ionen van de ene halfcel in de andere door kunnen dringen.
Dit is dan blijkbaar een uitzondering op de regel.
Vraag 5a: zie jij dan een andere oxidator in het systeem?
Dit is in feite een Volta cel waarbij Zn vervangen is door Mg.
Over Volta cel is op dit forum al vaak geschreven. Gebruik zoekfunctie linksboven.

Dit lijkt niet het volledige vraagstuk.
HCl (zoutzuur) zal Fe oplossen zodat er FeCl2 ontstaat. Daar twijfel je toch niet aan?
Cl2 lost nauwelijks op in water.
Als je twijfelt tussen twee mogelijke antwoorden, lees dan het vraagstuk nog eens zeer aandachtig door ("wanneer opgelost") en als je dan nog twijfelt kies de simpelste oplossing. Je doet immers middelbare school, geen universiteit.
Dit lijkt ook weer niet het volledige vraagstuk.De vraag bij deze elektrochemische cel is dat ik moet uitleggen waarom er geen membraan nodig is.
Een membraan of zoutbrug als verbinding tussen twee halfcellen is nodig als voorkomen moet worden dat de verkeerde ionen van links naar rechts en/of van rechts naar links kunnen gaan. Dat is hier niet het geval, er zijn geen storende ionen die gestopt moeten worden.
De juiste zoutbrug bevat niet-storende ionen die langzaam vrijkomen aan z'n beide uiteinden. Alleen als je dezelfde zoutbrug ontzettend lang zou gebruiken dan zouden er storende ionen van de ene halfcel in de andere door kunnen dringen.
-
- Berichten: 24
Re: Aantal vragen betreft redoxreacties
H2O kan zowel als zuur en als base fungeren, het is wel een hele zwakke base/zuur, dus het gebeurt vaak niet. Ik heb niet de hele opgaves gestuurd, omdat ik er zeker van ben dat die informatie niet gaat helpen bij de beantwoording van mijn vragen, scheelt ook weer werk voor jou toch?
Kan je daar een voorbeeld van geven? Een zoutbrug bestaat dus uit een opgelost zout, oftewel positieve en negatieve ionen, waarmee hij de lading van de halfcellen corrigeert. Positieve ionen willen toch allemaal graag elektronen opnemen en negatieve ionen juist afstaan? Dit gebeurt dan toch ongetwijfeld onderling in de halfcel als de zoutbrug dus de ionen "loslaat"?Pinokkio schreef: De juiste zoutbrug bevat niet-storende ionen die langzaam vrijkomen aan z'n beide uiteinden. Alleen als je dezelfde zoutbrug ontzettend lang zou gebruiken dan zouden er storende ionen van de ene halfcel in de andere door kunnen dringen.
- Pluimdrager
- Berichten: 2.386
Re: Aantal vragen betreft redoxreacties
Juist niet. Wij hebben niets aan uit hun verband gerukte vragen.Ik heb niet de hele opgaves gestuurd, omdat ik er zeker van ben dat die informatie niet gaat helpen bij de beantwoording van mijn vragen, scheelt ook weer werk voor jou toch?
Telkens weer verliezen ik, en anderen, een hoop tijd omdat de vragenstellers niet het volledige vraagstuk willen posten maar slechts hun interpretatie ervan.
Plaats altijd een foto van het volledige vraagstuk.
De zoutbrug moet ionen bevatten die onder de omstandigheden in de halfcellen geen elektronen zullen opnemen of afgeven, en dus niet storen.
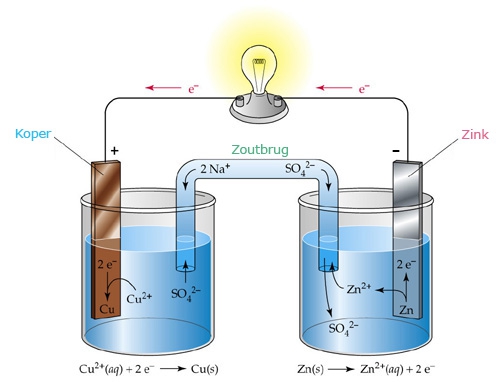
In een Daniell cel gebruik je bijvoorbeeld een zoutbrug met Na2SO4 erin omdat Na+ en SO42- niet zullen reageren:
- Berichten: 10.563
Re: Aantal vragen betreft redoxreacties
Met betrekking tot de reactie tussen CaH2 en H2O:
Je geeft aan dat er geen elektronenoverdracht is, maar als je de oxidatiegetallen van de elementen voor en na de pijl afleidt zie je meteen dat dat wél het geval moet zijn: Na de pijl staat Ca2+, als dat voor de pijl ook al Ca2+ was, dan was H dus H- en dus oxidatietoestand -1. Na de pijl staan 2 H-atomen met oxidatietoestand +2 (in OH-) en 2 H-atomen met oxidatietoestand 0. De oxidatietoestand van H moet dus veranderd zijn, en dus is er sprake van een redoxreactie.
De totaalreactie is op te stellen uit een halfreactie met H2O als oxidator (staat in de tabel) en een halfreactie gebaseerd op H- als reductor (idem). Een omweg via H+ als oxidator is niet juist, omdat die alleen optreedt in een milieu waar daadwerkelijk H+ aanwezig is, zuur milieu dus.
H- is niet enkel een theoretische base. Het bestaat echt, en het reageert echt door H+ op te nemen en H2 te vormen. Maar het is wel een verschrikkelijk sterke base, zo sterk dat het met gemak met het zeer zwakke zuur H2O reageert.
De reactie tussen H2O en H- is dus een zuur-basereactie én een redoxreactie. Het is zo ongeveer de enige uitzondering; bij gebruikelijke zuur-basereacties wordt een H+ overgedragen, van bijvoorbeeld een O-atoom naar een ander O-atoom, of een N-atoom, of wat dan ook. De oxidatietoestand van H verandert daarbij niet (blijft +1).
Bij deze reactie wordt een H+ overgedragen naar een H- en daarbij verandert de oxidatietoestand van beide H-atomen omdat die in het eindproduct 0 is. Daardoor is het een redoxreactie.
Er zijn nog wel andere voorbeelden te verzinnen in reacties van bijvoorbeeld lithium-aluminiumhydride (LiAlH4) of natriumboorhydride (NaBH4) met water of alcoholen, maar in feite komen die op hetzelfde neer: in de betreffende stof zit H met een oxidatietoestand van -1, en die verandert naar 0. Maar de genoemde reacties zijn geen middelbareschoolstof.
Met betrekking tot de oxidatie van ethanol: vermoedelijk staat de betreffende halfreactie in je tabel met halfreacties. Verder zou je het niet moeten hoeven zoeken. Het is inderdaad mogelijk ethanol verder te oxideren tot azijnzuur en tot CO2, vraag het anders aan een willekeurige gistcel, maar die halfreacties staan dan vaak weer niet in tabellen met redox-halfreacties. De oxidatie tot ethanal wel omdat die ook gebruikt werd/wordt bij alcohol-(blaas)testen, en daar kun je dan weer (examen)vragen over stellen.
Je geeft aan dat er geen elektronenoverdracht is, maar als je de oxidatiegetallen van de elementen voor en na de pijl afleidt zie je meteen dat dat wél het geval moet zijn: Na de pijl staat Ca2+, als dat voor de pijl ook al Ca2+ was, dan was H dus H- en dus oxidatietoestand -1. Na de pijl staan 2 H-atomen met oxidatietoestand +2 (in OH-) en 2 H-atomen met oxidatietoestand 0. De oxidatietoestand van H moet dus veranderd zijn, en dus is er sprake van een redoxreactie.
De totaalreactie is op te stellen uit een halfreactie met H2O als oxidator (staat in de tabel) en een halfreactie gebaseerd op H- als reductor (idem). Een omweg via H+ als oxidator is niet juist, omdat die alleen optreedt in een milieu waar daadwerkelijk H+ aanwezig is, zuur milieu dus.
H- is niet enkel een theoretische base. Het bestaat echt, en het reageert echt door H+ op te nemen en H2 te vormen. Maar het is wel een verschrikkelijk sterke base, zo sterk dat het met gemak met het zeer zwakke zuur H2O reageert.
De reactie tussen H2O en H- is dus een zuur-basereactie én een redoxreactie. Het is zo ongeveer de enige uitzondering; bij gebruikelijke zuur-basereacties wordt een H+ overgedragen, van bijvoorbeeld een O-atoom naar een ander O-atoom, of een N-atoom, of wat dan ook. De oxidatietoestand van H verandert daarbij niet (blijft +1).
Bij deze reactie wordt een H+ overgedragen naar een H- en daarbij verandert de oxidatietoestand van beide H-atomen omdat die in het eindproduct 0 is. Daardoor is het een redoxreactie.
Er zijn nog wel andere voorbeelden te verzinnen in reacties van bijvoorbeeld lithium-aluminiumhydride (LiAlH4) of natriumboorhydride (NaBH4) met water of alcoholen, maar in feite komen die op hetzelfde neer: in de betreffende stof zit H met een oxidatietoestand van -1, en die verandert naar 0. Maar de genoemde reacties zijn geen middelbareschoolstof.
Met betrekking tot de oxidatie van ethanol: vermoedelijk staat de betreffende halfreactie in je tabel met halfreacties. Verder zou je het niet moeten hoeven zoeken. Het is inderdaad mogelijk ethanol verder te oxideren tot azijnzuur en tot CO2, vraag het anders aan een willekeurige gistcel, maar die halfreacties staan dan vaak weer niet in tabellen met redox-halfreacties. De oxidatie tot ethanal wel omdat die ook gebruikt werd/wordt bij alcohol-(blaas)testen, en daar kun je dan weer (examen)vragen over stellen.
Cetero censeo Senseo non esse bibendum
-
- Berichten: 24
Re: Aantal vragen betreft redoxreacties
Oke duidelijk, dan zal ik voortaan het hele vraagstuk posten!
Klopt het volgende wat ik zeg over de Daniell cel van hierboven: in de rechterhalfcel is de oplossing positief geladen, doordat de elektronen via de stroomdraad naar de linker halfcel worden gevoerd en er dus van de redoxreactie alleen Zn2+ ionen overblijven in de oplossing. Hierdoor zal de zoutbrug SO42- vrijlaten om de positieve lading te compenseren. En blijkbaar gaat er ook Zn2+ in de zoutbrug zitten daarvoor?
In de linkercel gebeurt dan het omgekeerde, in de oplossing zitten door de stroomgeleiding te veel elektronen, dus de zoutbrug zal Na+ laten vrijkomen.
Maar wat ik dus nog niet snap is: als bovenstaande klopt zit Zn2+ dus in de zoutbrug, kan de Zn2+ dan ook niet uiteindelijk in de linkerhalfcel terecht komen? En kan deze halfreactie dan niet ook op gaan treden in de Daniell cel: Na+ + e- -> Na(s) (hetzelfde voor het andere ion van de zoutbrug, maar in dit geval is dat niet mogelijk omdat SO42- alleen een oxidator is in warm, geconcentreerd H2SO4, maar als er een ander ion in de plaats van SO42- was gebruikt, dan zou ik nog een halfreactie verwachten)
En waarom zit er SO42- in de linkerhalfcel, met een pijltje terug de zoutbrug in? Heeft dat toevallig iets te maken met hetgeen waar ik in de 2e alinea een vraag over had?
Klopt het volgende wat ik zeg over de Daniell cel van hierboven: in de rechterhalfcel is de oplossing positief geladen, doordat de elektronen via de stroomdraad naar de linker halfcel worden gevoerd en er dus van de redoxreactie alleen Zn2+ ionen overblijven in de oplossing. Hierdoor zal de zoutbrug SO42- vrijlaten om de positieve lading te compenseren. En blijkbaar gaat er ook Zn2+ in de zoutbrug zitten daarvoor?
In de linkercel gebeurt dan het omgekeerde, in de oplossing zitten door de stroomgeleiding te veel elektronen, dus de zoutbrug zal Na+ laten vrijkomen.
Maar wat ik dus nog niet snap is: als bovenstaande klopt zit Zn2+ dus in de zoutbrug, kan de Zn2+ dan ook niet uiteindelijk in de linkerhalfcel terecht komen? En kan deze halfreactie dan niet ook op gaan treden in de Daniell cel: Na+ + e- -> Na(s) (hetzelfde voor het andere ion van de zoutbrug, maar in dit geval is dat niet mogelijk omdat SO42- alleen een oxidator is in warm, geconcentreerd H2SO4, maar als er een ander ion in de plaats van SO42- was gebruikt, dan zou ik nog een halfreactie verwachten)
En waarom zit er SO42- in de linkerhalfcel, met een pijltje terug de zoutbrug in? Heeft dat toevallig iets te maken met hetgeen waar ik in de 2e alinea een vraag over had?
-
- Berichten: 24
Re: Aantal vragen betreft redoxreacties
Helemaal duidelijk nu! De oxidatie tot ethanal staat niet in de binas, alleen halfreacties van een aantal ionen.Marko schreef: Met betrekking tot de reactie tussen CaH2 en H2O:
Je geeft aan dat er geen elektronenoverdracht is, maar als je de oxidatiegetallen van de elementen voor en na de pijl afleidt zie je meteen dat dat wél het geval moet zijn: Na de pijl staat Ca2+, als dat voor de pijl ook al Ca2+ was, dan was H dus H- en dus oxidatietoestand -1. Na de pijl staan 2 H-atomen met oxidatietoestand +2 (in OH-) en 2 H-atomen met oxidatietoestand 0. De oxidatietoestand van H moet dus veranderd zijn, en dus is er sprake van een redoxreactie.
De totaalreactie is op te stellen uit een halfreactie met H2O als oxidator (staat in de tabel) en een halfreactie gebaseerd op H- als reductor (idem). Een omweg via H+ als oxidator is niet juist, omdat die alleen optreedt in een milieu waar daadwerkelijk H+ aanwezig is, zuur milieu dus.
H- is niet enkel een theoretische base. Het bestaat echt, en het reageert echt door H+ op te nemen en H2 te vormen. Maar het is wel een verschrikkelijk sterke base, zo sterk dat het met gemak met het zeer zwakke zuur H2O reageert.
De reactie tussen H2O en H- is dus een zuur-basereactie én een redoxreactie. Het is zo ongeveer de enige uitzondering; bij gebruikelijke zuur-basereacties wordt een H+ overgedragen, van bijvoorbeeld een O-atoom naar een ander O-atoom, of een N-atoom, of wat dan ook. De oxidatietoestand van H verandert daarbij niet (blijft +1).
Bij deze reactie wordt een H+ overgedragen naar een H- en daarbij verandert de oxidatietoestand van beide H-atomen omdat die in het eindproduct 0 is. Daardoor is het een redoxreactie.
Er zijn nog wel andere voorbeelden te verzinnen in reacties van bijvoorbeeld lithium-aluminiumhydride (LiAlH4) of natriumboorhydride (NaBH4) met water of alcoholen, maar in feite komen die op hetzelfde neer: in de betreffende stof zit H met een oxidatietoestand van -1, en die verandert naar 0. Maar de genoemde reacties zijn geen middelbareschoolstof.
Met betrekking tot de oxidatie van ethanol: vermoedelijk staat de betreffende halfreactie in je tabel met halfreacties. Verder zou je het niet moeten hoeven zoeken. Het is inderdaad mogelijk ethanol verder te oxideren tot azijnzuur en tot CO2, vraag het anders aan een willekeurige gistcel, maar die halfreacties staan dan vaak weer niet in tabellen met redox-halfreacties. De oxidatie tot ethanal wel omdat die ook gebruikt werd/wordt bij alcohol-(blaas)testen, en daar kun je dan weer (examen)vragen over stellen.
- Pluimdrager
- Berichten: 2.386
Re: Aantal vragen betreft redoxreacties
Die Daniell cel bevat links een oplossing van CuSO4 en rechts een oplossing van ZnSO4
Vandaar dat er links SO42- de zoutbrug in gaat.
Omdat beide oplossingen sulfaten zijn is het in dit geval elegant om in de zoutbrug ook een sulfaat te gebruiken, maar dat hoeft niet. Dat mag ook een chloride of een nitraat of ....... zijn zolang het maar niet reageert in de halfcellen.
Ook hoeft het kation in de zoutbrug niet persé Na+te zijn, dat mag ook K+ of Li+ of ....... zijn zolang het maar niet reageert in de halfcel. Genoemde kationen zullen geen e- opnemen aan de elektrodes en zijn dus in feite inert.
Doordat er links Cu2+ uit de oplossing als Cu op de elektrode neerslaat zou er een overschot aan SO42- zijn als er geen SO42- de brug in zou gaan, of er Na+ uit de zoutbrug komt.
Transport in en uit de zoutbrug zal zodanig zijn dat kationen en anionen in ladingevenwicht blijven.
Doordat er rechts Zn uit de elektrode als Zn2+ in oplossing gaat moet er dus ter compensatie een anion (in dit geval SO42-) uit de zoutbrug komen of een Zn2+ ion de zoutbrug in gaan. Beiden gebeuren.
Zoals ik al eerder zei: als je dezelfde zoutbrug ontzettend lang zou gebruiken dan zouden er storende ionen van de ene halfcel in de andere door kunnen dringen.
Uiteindelijk zouden dan immers alle Na+ kationen in de zoutbrug vervangen zijn door Zn2+ kationen en dan werkt de zoutbrug natuurlijk niet meer als blokkade voor Zn2+
Vandaar dat er links SO42- de zoutbrug in gaat.
Omdat beide oplossingen sulfaten zijn is het in dit geval elegant om in de zoutbrug ook een sulfaat te gebruiken, maar dat hoeft niet. Dat mag ook een chloride of een nitraat of ....... zijn zolang het maar niet reageert in de halfcellen.
Ook hoeft het kation in de zoutbrug niet persé Na+te zijn, dat mag ook K+ of Li+ of ....... zijn zolang het maar niet reageert in de halfcel. Genoemde kationen zullen geen e- opnemen aan de elektrodes en zijn dus in feite inert.
Doordat er links Cu2+ uit de oplossing als Cu op de elektrode neerslaat zou er een overschot aan SO42- zijn als er geen SO42- de brug in zou gaan, of er Na+ uit de zoutbrug komt.
Transport in en uit de zoutbrug zal zodanig zijn dat kationen en anionen in ladingevenwicht blijven.
Doordat er rechts Zn uit de elektrode als Zn2+ in oplossing gaat moet er dus ter compensatie een anion (in dit geval SO42-) uit de zoutbrug komen of een Zn2+ ion de zoutbrug in gaan. Beiden gebeuren.
Zoals ik al eerder zei: als je dezelfde zoutbrug ontzettend lang zou gebruiken dan zouden er storende ionen van de ene halfcel in de andere door kunnen dringen.
Uiteindelijk zouden dan immers alle Na+ kationen in de zoutbrug vervangen zijn door Zn2+ kationen en dan werkt de zoutbrug natuurlijk niet meer als blokkade voor Zn2+