Ik weet niet goed wat ik in dit verband aan moet met opmerkingen als
sp3-hybridisatie : Hier dus de mogelijk onbeholpen benadering, ik zou naar de ruimtelijke structuur en de elektronegativiteit van de bouwstenen kijken:
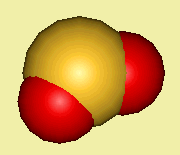
SO
2 in elk geval al wél, want S en O hebben geen gelijke elektronegativiteit en SO
2 is niet ruimtelijk symmetrisch.
Van die andere verbindingen kan ik geen plaatjes vinden, maar ik kan me voorstellen dat SBr
2 net zomin symmetrisch is als SO
2.
SOBr
2 zou ruimtelijk symmetrisch kunnen zijn (al vermoed ik van niet), maar kan ik me niet voorstellen als een elektrisch symmetrisch molecuul.
Blijft over SBr
4. Dat lijkt me het molekuul dat zowel ruimtelijk als elektrisch symmetrisch kan zijn.
komen we op deze basis verder?

