Pagina 1 van 1
cilinder
Geplaatst: za 11 mei 2019, 20:33
door ukster
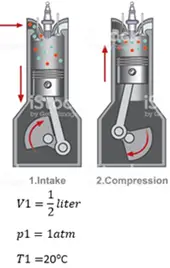
- cilinder dieselmotor.png (35.88 KiB) 2801 keer bekeken
de te leveren arbeid voor een compressiefactor 15 kan op 2 manieren worden opgelost.
Bij een ervan is het aantal mol nodig.
Hoe kan dat worden berekend?
Re: cilinder
Geplaatst: za 11 mei 2019, 22:04
door Pinokkio
ideale gaswet
Re: cilinder
Geplaatst: za 11 mei 2019, 22:09
door ukster
ik bedoel hier het aantal mol's in W=-nCv(T2-T1)
Re: cilinder
Geplaatst: zo 12 mei 2019, 10:28
door Pinokkio
Het aantal mol n verandert toch niet tijdens de compressie?
Maar voor de duidelijkheid: plaats eens een foto van het gehele vraagstuk.
Re: cilinder
Geplaatst: zo 12 mei 2019, 14:01
door ukster
Pinokkio schreef:
Het aantal mol n verandert toch niet tijdens de compressie?
Nee.
n moet wel bekend zijn om de formule te kunnen invullen!
Op Wikipedia vind ik een molair volume 22,414liter/mol voor zuurstof(1atm/0ºC)
voor 0,5liter/20ºC/1atm denk ik # mol te vinden met n=(0,5/22,414)*(273/293)=0,0208 mol
Zuurstof O2(diatomic gas): C
v=(5/2)R γ =1,4
T2=T1(V1/V2)
γ -1= 865,6K~593ºC
Benodigde arbeid voor een compressieslag: W=-nC
v(T2-T1)=-0,0208*(5/2)*8,31*(865,6-293)=-247J
De andere manier W=-Cv/R(p2V2-p1V1) zal dan hetzelfde resultaat moeten geven!
Re: cilinder
Geplaatst: zo 12 mei 2019, 14:16
door Pinokkio
Jouw uitroeptekens verhullen niet dat je de ideale gaswet niet schijnt te kennen, danwel dat je niet weet hoe je daarmee n kunt berekenen.
Het is essentieel dat je dat wel kunt voordat je verder gaat met thermodynamica.
Dus vooruit, bereken n met de IGW.
Re: cilinder
Geplaatst: zo 12 mei 2019, 14:24
door ukster
Ben inderdaad niet goed bekend met thermodynamica.
Lijkt me een zeer boeiend vakgebied.
Daar gaat ie dan
pV=nRT
n=pV/(RT)=(101325)(0,5.10-3)/(8,31*293)=0,0208
Re: cilinder
Geplaatst: zo 12 mei 2019, 14:50
door Pinokkio
Correct.
Benodigde arbeid voor een compressieslag: W=-nCv(T2-T1)=-0,0208*(5/2)*8,31*(865,6-293)=-247J
De andere manier W=-Cv/R(p2V2-p1V1) zal dan hetzelfde resultaat moeten geven!
In deze formules is W
niet de
benodigde arbeid maar de
geleverde arbeid.
Geleverde arbeid is
-247 J dus benodigde arbeid is
+247 J.
Re: cilinder
Geplaatst: zo 12 mei 2019, 14:54
door ukster
Oke, gelukkig heb ik mezelf al gecorrigeerd in bericht#1
Re: cilinder
Geplaatst: zo 12 mei 2019, 15:45
door Pinokkio
Algemeen: het hangt van het gebruikte boek (of website) af hoe men daar W definieert.
De ene bron definieert W als toegevoerde arbeid, de andere als geleverde arbeid.
Dat verschil is dan ook zichtbaar in hun schrijfwijze van de eerste hoofdwet.
Bij het raadplegen van een nieuwe bron altijd eerst even checken (symbolenlijst of 1e hoofdwet) hoe men daar W definieert.
Re: cilinder
Geplaatst: zo 12 mei 2019, 16:05
door ukster
Ik kan me goed voorstellen dat een definitie zou zijn: de door (interne gasenergie) geleverde arbeid positief, dus compressiearbeid negatief.
dus W=-ΔU voor een adiabatisch proces
Re: cilinder
Geplaatst: ma 13 mei 2019, 10:57
door Pinokkio
Thermodynamica is oorspronkelijk ontwikkeld voor de omzetting van warmte (Q) in arbeid (W). Daarom werd oorspronkelijk in alle geschriften W gedefiniëerd als geleverde arbeid.
De eerste hoofdwet werd dus geschreven als: ΔU = Q - W
Maar tegenwoordig zijn er steeds meer boeken, artikelen en websites die W definiëren als toegevoerde arbeid en de eerste hoofdwet schrijven als:
ΔU = Q + W
Dit heeft natuurlijk ook invloed op de schrijfwijze van andere formules, inclusief de twee die jij boven gebruikt.
Het maakt allemaal niets uit voor ervaren mensen, maar het kan verwarrend zijn voor beginners, vooral als men twee verschillende bronnen naast elkaar gebruikt die een verschillende definitie voor W gebruiken.
Dus altijd eerst even checken wat men met W bedoelt; kijk bijvoorbeeld naar hoe men de eerste hoofdwet schrijft.
Re: cilinder
Geplaatst: ma 13 mei 2019, 11:20
door ukster
Oke, dank voor deze waardevolle informatie