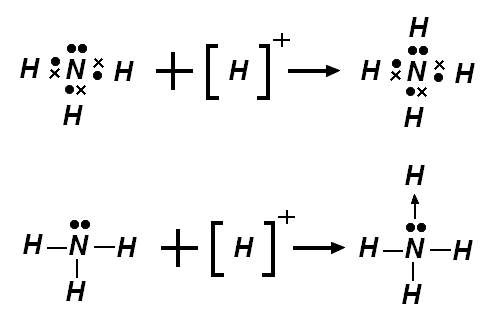In het tweede gedeelte staat in het rood de uitleg voor polyatomische ionen, hier nog even een korte nederlandse samenvatting:
- Tel het aantal valentie-elektronen en trek of tel daar de lading bij op.
- Tel het aantal elektronen dat de molecule zou hebben moest ieder atoom zijn octetconfiguratie bereiken.
- Trek het aantal valentie-elektronen af van het aantal octetelektronen. Dus stap 2 stap 1.
- Het gevonden aantal elektronen (=bindingselektronen) deel je door twee waardoor je het aantal bindingen krijgt.
- Teken de structuur met de bindingen
- Trek het aantal bindingselektronen af van het aantal valentie-elektronen (stap 1 stap 4). Je bekomt het aantal vrije valentie-elektronen.
- Deel het aantal valentie-elektronen door 2 om het aantal valentie-elektronenparen te bekomen
- Teken en plaats ladingen
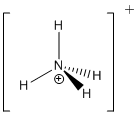
Ik doe het even voor voor NH
4+
- 5 + 4 1 = 8 elektronen
- 8 + 2*4 = 16 elektronen
- 16 8 = 8 bindingselektronen
- 8/2 = 4 bindingen
- 8 valentie-elektronen 8 bindingselektronen = 0 vrije valentie-elektronen
- 0 VEP (valentie-elektronenparen)
Probeer nu zelf nog eens voor je chloraat-ion. Iets moeilijker maar volgens hetzelfde principe.

PS: datieve bindingen zijn eigenlijk niet van belang bij het tekenen van lewisstructuren. Merk op dat je bij NH
4+ ook een datieve binding hebt.
"Success is the ability to go from one failure to another with no loss of enthusiasm" - Winston Churchill