Stefke1000 schreef: ↑do 14 nov 2013, 19:41
- naar mijn weten bestaat een eiwit uit een keten van meerdere aminozuren. Bij de primaire structuur op bovenstaande site staat hiervan dit:
A
T
R
R
Y
Y
L
G
A
V
E
L
S
W
D
Y
M
Q
S
D
L
G
E
L
P
V
D
A
R
F
P
P
R
V
P
K
S
F
P
F
N
T
S
V
V
Y
K
K
T
L
F
V
E
F
T
D
H
L
F
N
Waar staan de bovenstaande letters voor? voor een aminozuur?
Dat klopt, een eiwit bestaat inderdaad uit een lange aaneenschakeling van verschillende aminozuren. Aminozuren kan je voluit schrijven, maar ieder aminozuur heeft ook een officiële 3-letter en 1-lettercode. Op die manier staat bijv. A voor Alanine (Ala), T voor Threonine (Thr) en R voor Arginine (Arg). Uit die aminozuursequentie die daar staat kan je dus al eenvoudig de eerste aminozuren aflezen en zien welke daarop volgen.
Ter info: de volledige lijst met 1- en 3-lettercodes kan je
hier lezen.
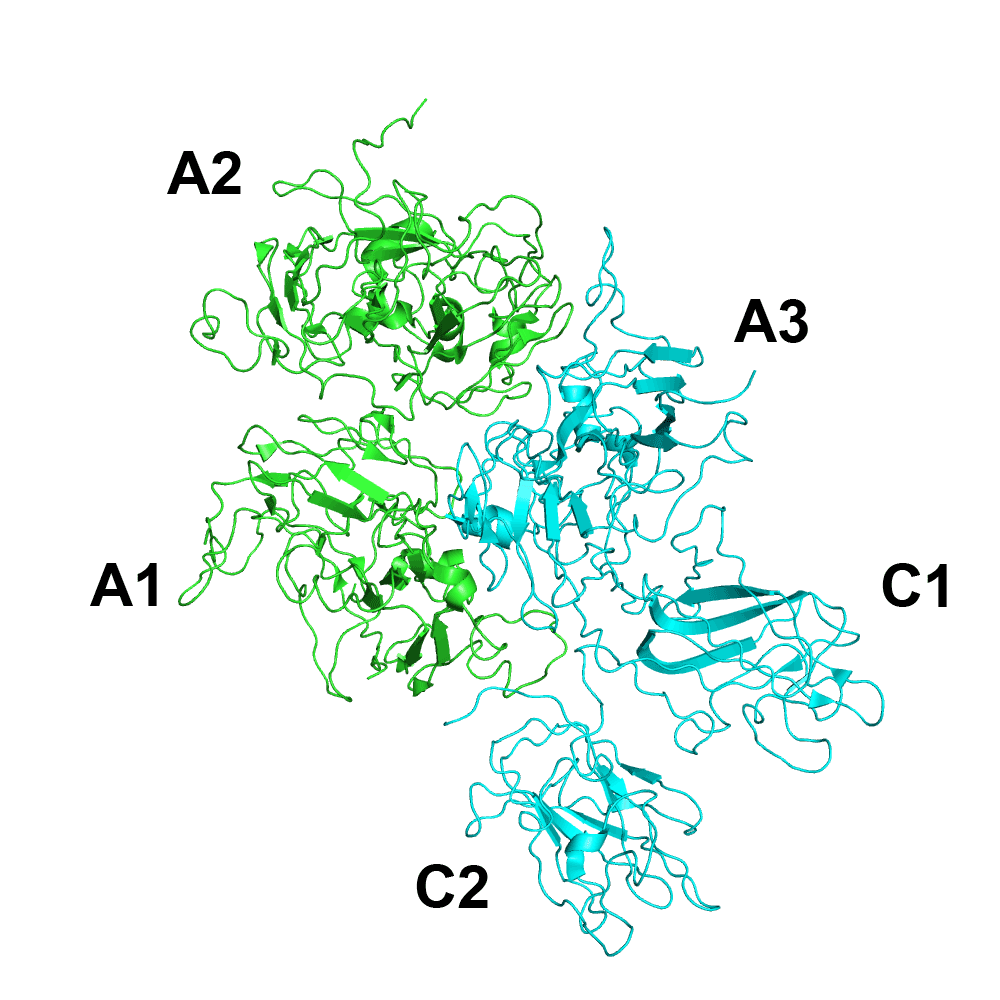
- Wat valt er bij dit eiwit te zeggen over de quaternaire structuur? Bestaat dit eiwit eigenlijk uit twee aaneengeschakelde eiwitten (A en C)?
Dat klopt ook. Qua eiwitstructuur spreekt men over vier stadia
- De primaire structuur van een eiwit is gewoon de lineaire sequentie van aminozuren. Ieder aminozuur is covalent gebonden aan het volgende en alles vormt een soort van lange draad.
- In de secundaire structuur gebeuren lokale opvouwingen en ontstaan 3 dimensionale structuren zoals alfa-helices en beta-sheets (de pijlen op de figuur).
- De tertiaire structuur is vervolgens de volledige opvouwing van één eiwitketen.
- En bij de quaternaire structuur gaan meerdere opgevouwen eiwitketens met elkaar interageren waarbij ze een functioneel complex vormen.
Dat laatste is in jouw voorbeeld ook het geval. Je hebt de groene eiwitketen (de heavy chain) die interageert met de blauwe eiwitketen (light chain) en die samen één functioneel eiwit(complex) vormen, namelijk stollingsfactor VIII. Dergelijke eiwitten worden ook wel heterodimeren genoemd, ze bestaan uit twee (di) verschillende (hetero) eenheden.
- Het gen bij patiënten met hemofilie A is gemuteerd. Bij deze patiënten vind in veel gevallen wel een productie plaats van het eiwit factor VIII. Hoe kan het dat een gemuteerd gen toch de mogelijkheid heeft om een eiwit te maken?
Ik weet niet precies op welke mutatie het gaat, maar wat perfect mogelijk zou kunnen zijn is dat het gaat om een missense mutatie. Dit is een mutatie waardoor één aminozuur in de eiwitsequentie gewijzigd wordt door een ander. Zoiets kan onschuldig zijn, maar het kan ook de volledige opvouwing van het eiwit in de war sturen en op die manier de functionele activiteit blokkeren.
Een dergelijke mutatie zal dus niet direct de eiwitproductie beïnvloeden, maar de functie kan echter wel volledig verloren gaan.
Merk op: ik speculeer hier over het effect van een mogelijke mutatie, het is niet gezegd dat deze theorie correct is. Ik zou eerst eens moeten opzoeken welke mutaties gekend zijn bij patiënten met hemofilie A om een meer concretere onderbouwing te geven. Wat ik schreef is louter een suggestie van een mogelijke oorzaak met als doel het principe te schetsen.
"Success is the ability to go from one failure to another with no loss of enthusiasm" - Winston Churchill