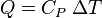adiabatisch proces + warmtecapaciteit
Geplaatst: za 22 jun 2013, 22:52
Hallo
In mijn cursus staat een voorbeeld waarbij een trekkracht aan een staaf wordt opgelegd met een kracht F. De staaf verlengt met dL. Gevraagd is de temperatuursstijging hierbij. Het draadtrekproces gaat zo snel dat het adiabatisch verloopt.
bovendien geldt
en uiteindelijk is ook geldig dat
maar nu...
In mijn cursus staat een voorbeeld waarbij een trekkracht aan een staaf wordt opgelegd met een kracht F. De staaf verlengt met dL. Gevraagd is de temperatuursstijging hierbij. Het draadtrekproces gaat zo snel dat het adiabatisch verloopt.
\( dU= \delta Q_p -pdV + FdL \)
met Q_p de warmtewisseling bij cte druk. Hiervoor staat er in mijn cursus trouwens\( {\delta Q_p}/{dT} = C_p (warmtecapaciteit) \)
.bovendien geldt
\( dH= dU + pdV + Vdp = FdL \)
want Q=0 (adiabatisch) en Vdp=0 (isobaar proces).en uiteindelijk is ook geldig dat
\( dH/dT= C_p \)
, hieruit haal je de temperatuurstijging.maar nu...
\( {dQ_p}/{dT} = C_p (warmtecapaciteit) \)
. Als je dit toepast, kom je een Q uit die niet gelijk is aan nul. Maar het proces is adiabatisch, dus ergens doe ik iets fout..weet iemand wat? [/url]
[/url]