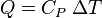De door jou genoemde formule:
[url=javascript:toonOfVerberg(]

[/url]
Dit plaatje is gegenereerd met de volgende code:
\([/color]
dU= \delta Q_p -pdV + FdL
[color=#AA0000]\)
[/color]
Handleiding werken met LaTeX
[url=javascript:toonOfVerberg(]sluiten[/url]
is eigenlijk de eerste hoofdwet. Energie is gelijk aan warmte plus arbeid. De volume arbeid gaat dus van de energie af, de kracht maal de uitrekking is een arbeid verricht op het systeem, dus die komt erbij. De Q
p valt weg omdat het adiabatisch is.
De definitie van enthalpie (H) is energie gecorrigeerd voor de volume verandering PdV. Daarmee is de formule om te schrijven tot:
dH=FdL (mits adiabatisch)
wanneer dH louter een warmte effect geeft en niet bijvoorbeeld een interne herordening, bijvoorbeeld van kristallijn naar amorf, of een andere structuur verandering die intern terecht komt, kan je dH zien als warmte. In dat geval zal al die warmte gebruikt gaan worden om de staaf op te warmen.
Dus als dH warmte is die binnen het systeem vrij komt en daar blijft, is:
dH/dT = C
p
Jouw verwarring zit er waarschijnlijk in de relatie dQ/dT = C
p
Dat geldt ook, want in algemeen geldt dat de warmte capaciteit iets zegt over de verandering in temperatuur door toevoegen of onttrekken van warmte.
Vergeet de formule waar je naar verwijst op wikipedia. Tenminste als je doelt op de formule voor gereduceerde warmte. De formule verderop:
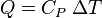
Kan je natuurlijk ook gebruiken.
Voor het oplossen van jouw probleem nog de vraag of FdL wellicht afhankelijk is van de temperatuur.
Succes.
 [/url]
[/url]