[scheikunde] Polaire binding/polaire molecule
Moderators: ArcherBarry, Fuzzwood
-
- Berichten: 23
Polaire binding/polaire molecule
Hallo,
Ik heb een klein vraagje over polariteit. Mijn leerkracht heeft gezegd dat een molecule een polaire binding kan hebben, maar een apolair molecule kan zijn. (bv. methaan). Hij heeft ons een paar oefeningen gegeven maar ik weet niet goed hoe ik eraan moet beginnen.
Hij zegt dat ik ze moet kunnen oplossen met de volgende gegevens: molecule tekenen, elektronegativiteit, symmetrie (voor bij dipoolmolecule?), Lewis structuur en de lading van een atoom, een tip was: kijken of het een ionbinding is of een atoombinding.
Kan u alstublieft uitleggen hoe dat kan een polaire binding en een apolair molecuul (voor eenzelfde molecuul) en hoe ik dat kan vinden met bovenste gegevens?
Alvast bedankt
Ik heb een klein vraagje over polariteit. Mijn leerkracht heeft gezegd dat een molecule een polaire binding kan hebben, maar een apolair molecule kan zijn. (bv. methaan). Hij heeft ons een paar oefeningen gegeven maar ik weet niet goed hoe ik eraan moet beginnen.
Hij zegt dat ik ze moet kunnen oplossen met de volgende gegevens: molecule tekenen, elektronegativiteit, symmetrie (voor bij dipoolmolecule?), Lewis structuur en de lading van een atoom, een tip was: kijken of het een ionbinding is of een atoombinding.
Kan u alstublieft uitleggen hoe dat kan een polaire binding en een apolair molecuul (voor eenzelfde molecuul) en hoe ik dat kan vinden met bovenste gegevens?
Alvast bedankt
-
- Berichten: 772
Re: Polaire binding/polaire molecule
Polair verbindingen treden op tussen atomen die een verschillende elektronegativiteit bezitten, apolaire verbindingen treden op tussen bindingen met eenzelfde elektronegativiteit. Ruwweg komt dit erop neer dat een binding polair is indien ze optreedt tussen twee verschillende atomen. Vbn zijn de bindingen:
C-H
C=O
C-Cl
Hierbij zijn resp de H,O en Cl veel elektronnegatievere elementen dan C.
Voorbeelden van apolaire bindingen:
C-C
H-H
Cl-Cl
Hieruit kun je alvast het polair - apolair zijn van een molecule ophelderen.
C-H
C=O
C-Cl
Hierbij zijn resp de H,O en Cl veel elektronnegatievere elementen dan C.
Voorbeelden van apolaire bindingen:
C-C
H-H
Cl-Cl
Hieruit kun je alvast het polair - apolair zijn van een molecule ophelderen.
-
- Berichten: 23
Re: Polaire binding/polaire molecule
Bedankt,
Maar kan u ook aub uitleggen waarom methaan dan een apolair molecule is en wat dat te maken heeft met de symmetrie?
Alvast bedankt
Maar kan u ook aub uitleggen waarom methaan dan een apolair molecule is en wat dat te maken heeft met de symmetrie?
Alvast bedankt
- Pluimdrager
- Berichten: 2.386
Re: Polaire binding/polaire molecule
In het methaanmolekuul zijn er vier C-H bindingen, die elk een intern partieel dipoolmoment hebben, doordat er een verschil is in EN tussen C en H, zoals al door NW_ uitgelegd. Dat zijn in feite vier vectoren, die door de ruimtelijke struktuur van CH4 in vier verschillende richtingen wijzen. Door de driedimensionale vorm van CH4 liggen de vier H-atomen symmetrisch rondom het C-atoom en dus heffen die vier vectoren elkaar precies op. Het dipoolmoment van het hele CH4 is gelijk aan de vectoriële som van die vier partiële dipoolmomenten, en is dus nul. En daardoor is CH4 apolair.Maar kan u ook aub uitleggen waarom methaan dan een apolair molecule is en wat dat te maken heeft met de symmetrie?
Apolaire molekulen, zoals CH4, trekken elkaar toch aan vanwege de van der Waals krachten (London dispersiekrachten). Simpel gezegd: doordat de elektronen binnen een molekuul bewegen zijn ze telkens eventjes net niet symmetrisch over een apolair molekuul (zoals CH4) verdeeld, en ontstaan er daardoor spontaan telkens heel even tijdelijke dipolen. En als gevolg van die tijdelijke dipooltjes trekken apolaire molekulen elkaar toch aan d.m.v. polaire krachten.Mijn leerkracht heeft gezegd dat een molecule een polaire binding kan hebben, maar een apolair molecule kan zijn. (bv. methaan).
Zou toch ook ergens in je cursusboek moeten staan.
Bekijk in ieder geval ook deze youtubefilmpjes:
- Berichten: 10.584
Re: Polaire binding/polaire molecule
Ik heb hier altijd (de vraag en de uitleg komen vaker voorbij) wat moeite mee.
De C-H binding is niet polair. Er is een klein verschil in elektronegativiteit (0.3), de grens die normaal gesproken wordt gehanteerd is dat een verschil van meer dan 0.4 op een polaire binding wijst. Nu is deze grens niet heel hard, maar een C-H binding gedraagt zich in de praktijk ook op geen enkele manier als een polaire binding.
C en H trekken ongeveer even hard aan de elektronen, daardoor is er sowieso geen sprake van positief en negatief geladen plaatsen in het molecuul.
Met andere woorden: Ook als methaan niet symmetrisch was geweest, was het apolair geweest.
Beter is om dit soort dingen uit te leggen aan de hand van CO2. Twee duidelijke polaire bindingen, maar overall een apolair molecuul.
De C-H binding is niet polair. Er is een klein verschil in elektronegativiteit (0.3), de grens die normaal gesproken wordt gehanteerd is dat een verschil van meer dan 0.4 op een polaire binding wijst. Nu is deze grens niet heel hard, maar een C-H binding gedraagt zich in de praktijk ook op geen enkele manier als een polaire binding.
C en H trekken ongeveer even hard aan de elektronen, daardoor is er sowieso geen sprake van positief en negatief geladen plaatsen in het molecuul.
Met andere woorden: Ook als methaan niet symmetrisch was geweest, was het apolair geweest.
Beter is om dit soort dingen uit te leggen aan de hand van CO2. Twee duidelijke polaire bindingen, maar overall een apolair molecuul.
Cetero censeo Senseo non esse bibendum
- Pluimdrager
- Berichten: 2.386
Re: Polaire binding/polaire molecule
Dit topic gaat niet specifiek over CH4
Omdat Christopbe dat als voorbeeld van een apolair molekuul noemde zijn NW_ en ik daarop verder gegaan.
Men leze eventueel CCl4 of CF4 in plaats van CH4 , dat verandert niets aan het verhaal.
Overigens is het beslist niet zo dat CH4 ook geen dipoolmoment zou hebben als het niet symmetrisch zou zijn.
Neem bijvoorbeeld propaan, wat niet symmetrisch is, maar wel degelijk een dipoolmoment heeft van 0,083 D omdat de kleine partiële dipooltjes van de diverse C-H bindingen elkaar niet precies tegenwerken (compenseren).
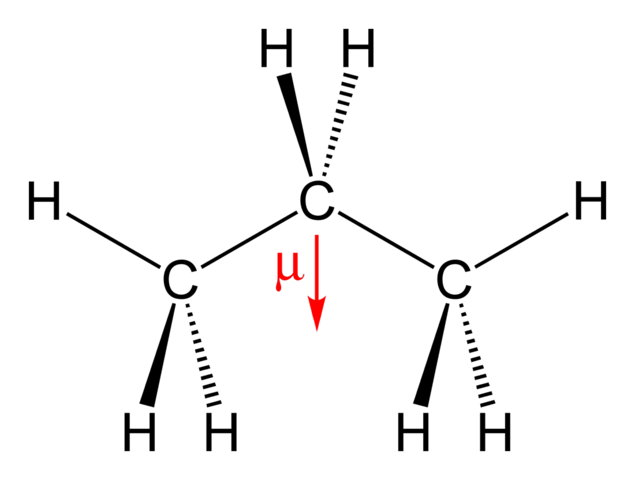
Omdat Christopbe dat als voorbeeld van een apolair molekuul noemde zijn NW_ en ik daarop verder gegaan.
Men leze eventueel CCl4 of CF4 in plaats van CH4 , dat verandert niets aan het verhaal.
Overigens is het beslist niet zo dat CH4 ook geen dipoolmoment zou hebben als het niet symmetrisch zou zijn.
Neem bijvoorbeeld propaan, wat niet symmetrisch is, maar wel degelijk een dipoolmoment heeft van 0,083 D omdat de kleine partiële dipooltjes van de diverse C-H bindingen elkaar niet precies tegenwerken (compenseren).

- Berichten: 10.584
Re: Polaire binding/polaire molecule
Dat weet ik, maar ik wil voorkomen dat door dat voorbeeld een verkeerd beeld ontstaat. Ik wil voorkomen dat mensen bij een molecuul als 2-methylpropaan of bij iso-octaan zouden redeneren dat het polaire stoffen zijn, omdat er polaire bindingen in voorkomen die elkaar niet uitmiddelen. Dat zou (aan de hand van de redenering over methaan) een volkomen logische, maar ook volkomen onjuiste conclusie zijn. Methaan is daarom geen goed voorbeeld.
Methaan is een mooi voorbeeld van een symmetrisch molecuul. Het is echter niet die symmetrie die het molecuul apolair maakt, dat doen de bindingen al. Wat dat betreft zijn CF4 en CCl4 veel beter, want daar zijn de bindingen wél polair, maar het molecuul niet.
Ik zeg ook niet dat CH4 geen dipoolmoment zou hebben als het asymmetrisch was geweest. Ik zeg dat het dan nog steeds apolair zou zijn. Er is een verschil tussen geen dipoolmoment en niet polair (apolair), en misschien is het juist dat verschil dat ik probeer aan te stippen.
Het verschil in elektronegativiteit tussen C en H is zó klein, de ladingsscheiding in de binding is daardoor zo klein, dat een molecuul, zelfs als deze ladingsscheiding niet volledig wordt uitgemiddeld, nooit polair zal zijn. Het zal nooit mengen met water, de oplosbaarheid van zouten is 0, enzovoort.
Methaan is een mooi voorbeeld van een symmetrisch molecuul. Het is echter niet die symmetrie die het molecuul apolair maakt, dat doen de bindingen al. Wat dat betreft zijn CF4 en CCl4 veel beter, want daar zijn de bindingen wél polair, maar het molecuul niet.
Ik zeg ook niet dat CH4 geen dipoolmoment zou hebben als het asymmetrisch was geweest. Ik zeg dat het dan nog steeds apolair zou zijn. Er is een verschil tussen geen dipoolmoment en niet polair (apolair), en misschien is het juist dat verschil dat ik probeer aan te stippen.
Het verschil in elektronegativiteit tussen C en H is zó klein, de ladingsscheiding in de binding is daardoor zo klein, dat een molecuul, zelfs als deze ladingsscheiding niet volledig wordt uitgemiddeld, nooit polair zal zijn. Het zal nooit mengen met water, de oplosbaarheid van zouten is 0, enzovoort.
Cetero censeo Senseo non esse bibendum
-
- Berichten: 23
Re: Polaire binding/polaire molecule
NW, Pinokkio en Marko hartelijk bedankt voor jullie uitleg. Nu heb ik er een beter beeld van en Pinokkio neen deze uitleg dat jullie mij gegeven hebben staat nergens in mijn cursus, omdat het een samenvatting is van andere cursussen (de uitgever is de leerkracht), daarom nog is hartelijk bedankt.